Hensikt
Sikre at NEQAS (SLP) prøver som MM mottar blir behandlet riktig og innenfor oppgitt tidsfrist.
Omfang
Månedlig utsendelse
Grunnlagsinformasjon
Historikk
MM har siden 2014 vært med i NEQAS AST (Antimicrobial Susceptibility Testing) programmet. Fra 2025 er MM også påmeldt generell bakteriologi (identifikasjon).
Arbeidsbeskrivelse
Ansvar
Faggruppe 1, bakteriologi har ansvar for administrasjon av Neqas AST, ID og MRSA.
Tildelt bioingeniør er ansvarlig for arbeid med, samt besvarelse av Neqas AST og ID.
Fagbioingeniør på faggruppe 1 og 2 er ansvarlig for rapportskriving på prøver med materialgrupper som faller inn under ansvarsområde.
Faggruppe genteknologi er ansvarlig for rapportskriving for MRSA.
HMS/sikkerhetsinformasjon
Regler for god laboratoriepraksis gjelder.
Referanse
Gjeldende brytningspunkt fra NordicAST
ARBEIDETS GANG
Prøvemateriale
Prøvene kommer på glass som frysetørret materiale.
Fremgangsmåte/Utførelse av analysen
Registering og utsåing
· Se dokumentet SLP og passord.xlsx for oversikt over hvem som har ansvar for aktuell forsendelse. Hver måned kommer 2 AST-prøver og 3 ID (generell bakteriologi)-prøver.
4 ganger i året kommer det også 2 Neqas-prøver til undersøkelse av MRSA. Person ansvarlig for AST og ID tar også ansvar for utførelse og besvarelse av MRSA.
Se fremgangsmåte for dette under «Ekstern kvalitetskontroll» (bakgrunn) i ALM-MM-PCR; Hurtigtest av MRSA, GeneXpert (Ikke tilgjengelig).
· Signer og dater forsendelsesskjema ved mottak.
· Registrer prøver i rekvisisjonsoppføring i Beaker:
o Rekvirent: HNT, Levanger Sh., Avdeling for laboratoriemedisin, Sammenlignende laboratorieprøving/Ekstern kvalitetsvurdering (SLP/EKV) {Ikkebet} {IkkeHP} HP-ID:1235000022
Pasientnavn: Neqas, UK
o Velg aktuell analyse for isolatet (aerob, anaerob, salmonella dyrkning, tarmpatogene bakterier etc.) og oppgitt prøvemateriale. ID-prøvene skal sås ut fra klinikk, så benytt valg av medier ALM-MM-Mottak; Valg av medier ved utsåing av bakteriologiske prøver for å vurdere hvilke analyser som skal bestilles (for fæcesprøver følges ALM-MM-Fæces; Vurdering, innlapping og primærutsæd av fæcesprøver. Det er kun nødvendig å kjøre bakt.panel på BD-max.
o Legg inn prøvenummer i forordningskommentar knyttet til respektiv analyse. Skriv også oppgitt isolat og klinikk.
(Tips: alle aktuelle analyser knyttet til en forsendelse kan legges til i samme rekvisisjonsoppføring.)
o Scan inn forsendelsesskjema
o I oppsettsbenk: For AST-prøver velges agar som man forventer at oppgitt isolat skal vokse på. For ID-prøver velges oppsett ut fra klinikk, som en vanlig pasientprøve, med unntak av direkte grampreparat.
· Utsåing:
Utsåing gjøres i sikkerhetskabinett, klasse 2. Metallforseglingen på toppen av glasset brytes av med en pinsett. Sprit av gummitoppen og tilsett 1ml buljong med sprøyte. Benytt glukosebuljong for aerobe bakterier og anaerobbuljong for anaerobe bakterier. Bland godt. La løsningen stå i 5 min. Benytt en steril pipette og overfør 1 dråpe av løsningen på dyrkningsmedium. Inkuber prøvene etter ordinære rutiner.
· Logg inn på UK Neqas sine hjemmesider. Innloggingsinformasjon finnes i SLP og passord.xlsx
Du kommer til følgende bilde:

For AST: Informasjon om hvilke antibiotika som er aktuelt å teste for hvert isolat ligger i resultatregistreringsbildet.
Gå på linja UK NEQAS for Antimicrobial susceptibility og velg i rullegardinmenyen aktuelt distribusjonsnummer og trykk på Result.

Gå til blank form og print ut.
Du får nå ut et arbeidsark tilsvarende det på nettet. Scan dette inn i rekvisisjonsoppføring i Beaker.
Videre arbeid
· FOR AST: Vi tester de antibiotika vi har tilgjengelig som står på skjemaet til Neqas. Spesialbioingeniør på faggruppe 1 har fullstendig oversikt over tilgjengelige antibiotika dersom man har behov for hjelp. Fortrinnsvis tester og rapporterer vi alltid lappediffusjon dersom det finnes brytningspunkt for dette i NordicAST. Dersom det kun eksisterer brytningspunkt for MIC tester og rapporterer vi gradienttest. Dersom vi ikke har etterspurt antibiotika for lappediffusjon, men vi har gradienttest, testes og rapporteres dette. OBS! Alle E.coli i urin skal settes opp på phoenix. Eventuelle midler som ikke dekkes opp av phoenix testes manuelt. En må også vurdere om midlene det spørres om er relevante i forhold til problemstillingen. Eksempel: dersom brytningspunkt kun gjelder UVI og vi har annet prøvemateriale, så rapporterer vi ikke dette i besvarelsen. Legg opp arbeidet slik at du får utført avlesninger dagen etter at du har satt opp følsomhetsbestemmelse. Frist for innsendelse står oppført på medfølgende skjema. Utfør alltid følsomhetsbestemmelse på dagsfersk kultur.
· FOR ID: Vurder patogene funn etter våre vurderingsprosedyrer. Alle identifikasjonstester vi har tilgjengelig skal benyttes, med unntak av Phoenix. Eksempler på dette er at S.aureus settes opp både med malditof og agglutinasjonstest, og positiv fæces PCR på bakterier som vi har medier til å dyrke frem skal identifiseres med malditof.
· All bakterieisolater fryses i -80°C, i egne frysbokser. Frysskjema finnes på Teams: Frysskjema NEQAS bokstype_4.xlsx
Svarrapportering
· FOR AST: Tolkning dobbeltsjekkes alltid mot NordicAST. Slik kan vi også oppdage om det er uoverensstemmelse med tolkningsregler i Beaker.
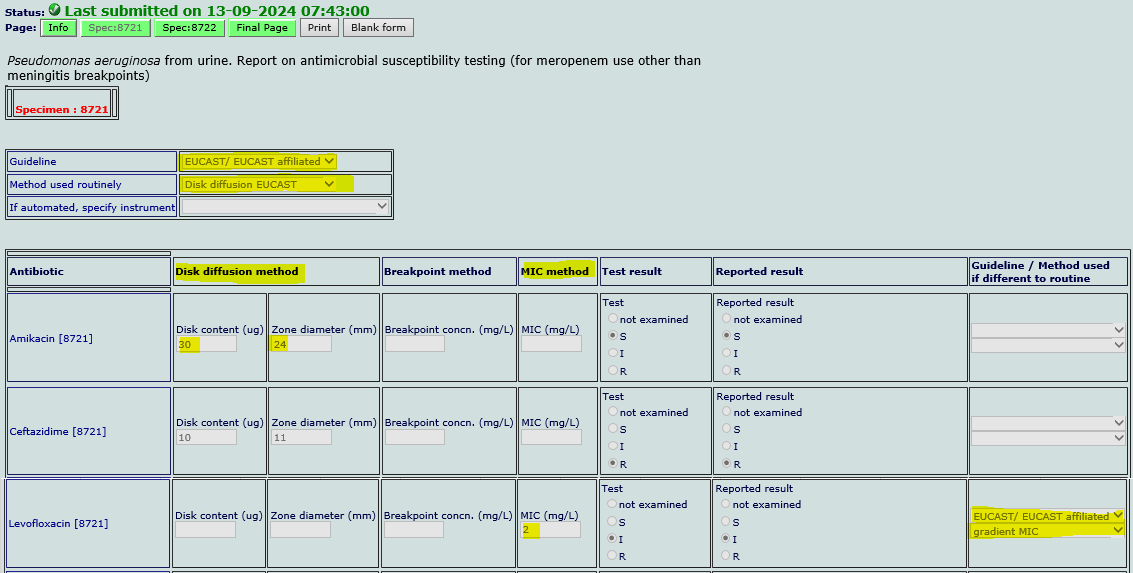
Under guideline og method legger vi inn Eucast og standard metode for vårt laboratorium. Dette vil i de fleste tilfeller være Disk diffusjon. Dersom vi i tillegg rapporterer antibiotika testet med en annen metode enn det vi har valgt som «default» kan vi velge dette bak aktuelt middel, slik som for Levofloxacin på eksempel over.
Under disk diffusjon rapporterer vi konsentrasjon på antibiotikalappene og sonediameter. Under MIC rapporterer vi kun MIC-verdien.
Test resultat: Her rapporterer vi det samme som «reported result».
Vi tar ikke hensyn til lokale utrapporteringsrutiner med M1, M2 etc, så alle resultat som har brytningspunkt mot spesifikk stamme og prøvemateriale skal legges inn med følsomhetskategori.
· For ID:
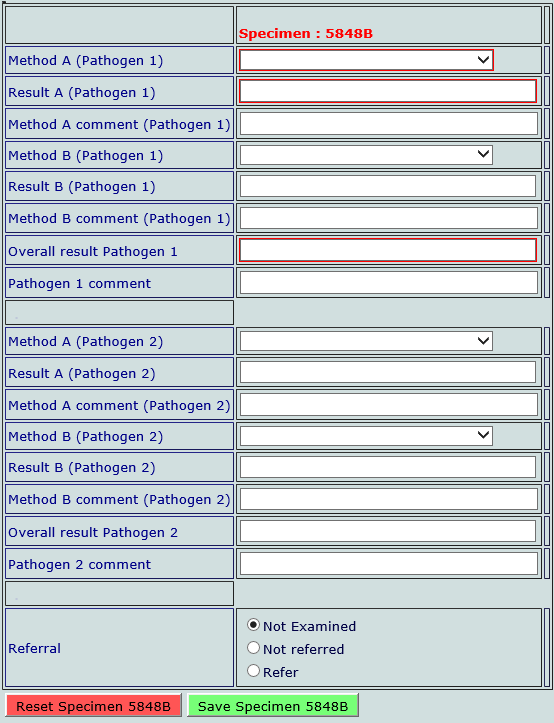
Under «Method» velger vi MALDI-ToF (bruker) for malditofresultat, «Molecular» for PCR og «Conventional tests» for alle andre tester. Legg inn instrument eller testnavn i kommentarfeltet. Velg aktuelt mikrobenavn som testen gir i «Result»-feltet. Legg inn svar som gis til rekvirent i «Overall result».
Under «Referral» velger vi «refer» dersom vi ville videresendt isolatet for videre undersøkelse.
· Ta kontakt med aktuell fagbioingeniør eller spesialbioingeniør ved spørsmål angående oppsett eller besvarelse.
· På «final page» skal dato for når vi mottok prøven legges inn.
· Trykk submit result når distribusjonen er klar for innlevering
· Verifiser svar i Beaker
· Legg inn all etterspurt informasjon i SLP og passord.xlsx
Legg merke til at MRSA har egen fane.
Spesielle hensyn:
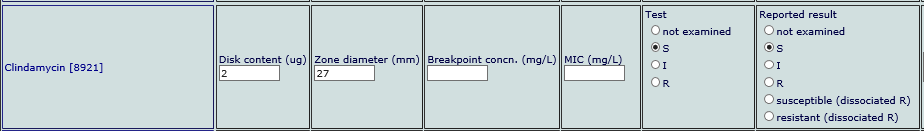
· Ved påvist induserbar klindamycinresistens: Under «reported result» velges «susceptible (dissociated R)»
· Vurdering/testing av ESBL hos Enterobacterales/Acinetobacter/Pseudomonas:
o Med ESBL menes ESBL-A. Dersom screeningsmidler ikke oppfyller kriterier kan disse besvares negativ. Dersom screeningsmidler oppfyller kriterier testes ESBL-A og M. UNNTAK: kromosomal AmpC kan besvares positiv, selv om screening er negativ.
o Carba: Dersom screeningsmidler ikke oppfyller kriterier kan disse besvares negativ. Dersom screeningsmidler oppfyller kriterier velger vi «not examined».