Arbeidsbeskrivelse
ANSVAR
Fagbioingeniør på med. mikrobiologi som er tillagt denne analysegruppen, har ansvar for vedlikehold av denne prosedyren og oppfølging av analysen. Fagbioingeniør for faggruppe preanalyse, blodgass og urin i Namsos, har det stedlige ansvaret for analysen.
HMS/sikkerhetsinformasjon
Ved PCR bruk må tillaging av panelet og bruk av FilmArray touch instrumentet gjøres på forskjellige steder eller arbeidsområder.
Ikke forlat et arbeidsområde eller returner til et tidligere arbeidsområde uten først å gjennomføre dekontaminering.
Regler for god laboratoriepraksis gjelder. Se også ALM-MM-; Hygiene og sikkerhetsrutiner på Lab. for med. mikrobiologi.
Et vanlig problem med PCR-baserte analyser er falskt positive resultater som følge av at arbeidsområdet er kontaminert med PCR-amplikon. Fordi BioFire BCID2 Panel-pouchen er et lukket system, er risikoen for kontaminering med amplikoner lav, forutsatt at pouchene fremdeles er hele når testen er fullført. Overhold følgende retningslinjer for å hindre kontaminering med amplikon:
- Pouchen skal kastes i beholder for biologisk farlig avfall umiddelbart etter at kjøringen er fullført.
- Unngå overdreven håndtering av pouchen etter kjøring av tester.
- Skift hansker etter å ha tatt i en brukt pouch.
- Unngå å utsette pouchen for skarpe kanter eller andre ting som kan punktere den.
Hvis det observeres væske på utsiden av pouchen, må væsken og pouchen umiddelbart legges i en tett pose og kastes i en beholder for biologisk farlig materiale. Instrumentet og arbeidsområdet må dekontamineres. Se under vedlikehold.
ARBEIDETS GANG
Analyseutstyr og klargjøring av disse
- FilmArray Torch: Instrumentet skal alltid værer påslått og er klart når det lyser tydelig grønt (lyser gulgrønn en stund før den blir klar).
- Pouch (reagenskasset): Pouchen er vakuumpakket. Hvis det ikke er vakuum kan dette påvirke resultatet og pouchen kasseres, hør etter tydelig svusj-lyd når vakuum brytes.
Straks pouchens emballasje er åpnet, skal pouchen fylles på så raskt som mulig (innen 30 minutter). Straks pouchen er fylt, skal analyseringen startes så raskt som mulig (innen 60 minutter).
- Pouchpåfyllingsstasjon
- Hydreringsinjeksjonsglass med hydreringsløsning
- Ampulle med prøvebuffer: Ampullen med prøvebuffer holdes slik at spissen vender opp. IKKE berører spissen på ampullen under håndtering, da dette kan medføre kontaminering.
- Prøveinjeksjonsglass
- Steril engangspipette
Fremgangsmåte/Utførelse av analysen
Håndtering av reagenser og utstyr til FilmArray skal alltid utføres med hansker og oppsettet skal utføres i avtrekksskap.
1. Hent ut prøvemateriale fra blodkulturflaske:
- Rekvirer analysen B-identifikasjon, blodkultur, akuttpanel PCR i Beaker, ligger som hurtigknapp i resultatregistrering.
- Bland blodkulturflasken godt før overføring.
- Tørk gummitoppen på blodkulturflasken med en Alco-swab.
- Overfør prøvemateriale til sterilt Vacuetteglass (hvit topp, ca. 3 mL) vha. Aerobic Venting Unit.
- Merk glasset med hoved-etikett fra Beaker.
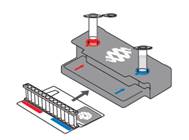
2. Klargjør pouchen:
- Plasser pouchen i anvist plass på pouchpåfyllingsstasjonen.
- Plasser prøveinjeksjonsglasset i rød brønn.
- Plasser hydreringsinjeksjonsglasset i blå brønn.
- Merk pouchen med den lille etiketten fra Beaker.
3. 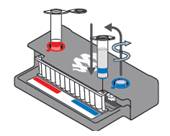 Hydrer pouchen:
Hydrer pouchen:
- Skru av lokket til hydreringsinjeksjonsglasset vha. påfyllingsstasjonen.
- Sett nålen i hydreringsporten på pouchen.
- Trykk kraftig ned på glasset for å punktere forseglingen. Observer at løsningen trekkes inn i pouchen.
- Hydreringsinjeksjonsglasset fjernes fra pouchen ved forsiktig, men bestemt å trekke nålen opp fra hydreringsporten. NB! Nålen kan være vanskelig å trekke opp.
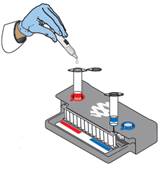
4. Klargjør prøveblanding
- Vend ampullen med prøvebuffer slik at spissen vender opp. Ikke berør spissen!
- Klem godt på den ruglete plastfliken på siden av ampullen, til forseglingen brytes.
- Med spissen vendt ned tilsettes prøvebufferen over i prøveinjeksjonsglasset med en rolig, men kraftig klemmebevegelse. Klem deretter en gang til, men unngå dannelsen av bobler.
- Tilsett 200 µL prøvemateriale fra Vacuette-glasset til prøveinjeksjonsglasset ved hjelp av medfølgende engangspipette (1 strek = 100 µL).
- Lukk lokket på prøveinjeksjonsglasset og bland godt ved å vende den forsiktig 3 ganger. Sett den så tilbake i den røde brønnen på pouchpåfyllingsstasjonen.
5. 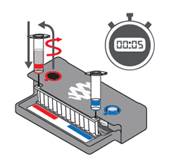 Fylle på prøveblanding
Fylle på prøveblanding
- Skru prøveinjeksjonsglasset fra lokket vha. pouchpåfyllingsstasjonen. Løft glasset litt opp og vent i 5 sekunder for å unngå søl.
- Sett prøveinjeksjonsglasset inn i pouchprøveporten.
- Trykk kraftig ned for å punktere forseglingen. Observer at løsningen trekkes inn i pouchen.
- Prøveinjeksjonsglasset fjernes fra pouchen ved forsiktig, men bestemt å trekke nålen opp fra prøveporten. NB! Nålen kan være vanskelig å trekke opp.
- Hydreringsinjeksjonsglasset, ampulle med prøvebuffer, engangspipetten, prøveinjeksjonsglasset, Vacuetteglasset med bld og Aerobic Venting Unit kastes i beholder for biologisk avfall (gul avfallsbeholder) i avtrekksskapet. Resterende avfall legges i gul avfallsboks utenfor avtrekkskapet når hansker tas av.
6. Kjør pouch:
- Ta på ren hanske på den hånden som skal håndtere pouchen.
-
Trykk på ![]() i hovedmenyen, evt.
trykk på
i hovedmenyen, evt.
trykk på ![]() for å komme til
hovedmenyen.
for å komme til
hovedmenyen.
- Skann barkoden til pouchen.
- Skann prøvenummeret (ID fra Beaker).
- Før pouchen inn i modulen. Skyv pouchen inn til instrumentet selv tar tak og trekker den helt inn. Når pouchen er korrekt satt inn vil LED-lyset blinke grønt. MERK at analyseringen har ikke startet enda.
- Logg inn med brukernavn og passord.
-
Skjermbilde for Review and Start Run kommer opp. Trykk ![]() .
.
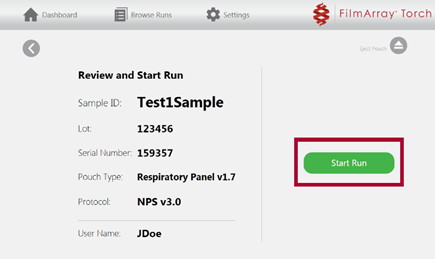
- Når analyseringen har startet vil LED-lampen lyse grønt kontinuerlig. Nytt skjermbildet, Run in Progress, vil vise gjenværende analysetid. Her kan man evt. avbryte analyseringen ved å trykke Abort.
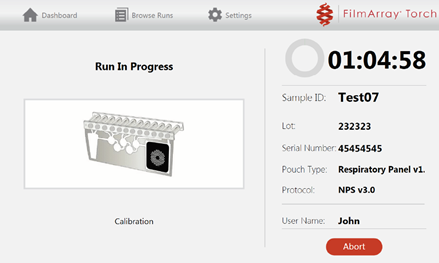
- Når analysen er startet tørkes påfyllingsstasjonen av etter bruk med 75% desinfeksjonssprit. Når den har tørket legges den i en plastpose før den legges tilbake i skuffen under GeneXpert.
- Avtrekkskapet rengjøres etter bruk. Tørk over med 75% desinfeksjonssprit
7. Analyseringen er ferdig:
- Når analysen er ferdig, vil modulen endre statusen til Finished i hovedmenyen og pouchen vil delvis komme ut. LED-lyset vil blinke blått.
-
Trykk ![]() for å få se rapporten. Det
vil tydelig fremgå av rapporten om oppsettet er godkjent (Controls: Passed)
og om blodkulturen er positiv på en eller flere agens. Øverst i rapporten står Run
Summery som inneholder: Sample ID, Organisms Detected, Applicable
Antimicrobial Resistance Genes Detected, Run Date, Controls: Passed.
for å få se rapporten. Det
vil tydelig fremgå av rapporten om oppsettet er godkjent (Controls: Passed)
og om blodkulturen er positiv på en eller flere agens. Øverst i rapporten står Run
Summery som inneholder: Sample ID, Organisms Detected, Applicable
Antimicrobial Resistance Genes Detected, Run Date, Controls: Passed.
- For svarrapportering se avsnitt lenger ned.
- Bruk hansker og fjern den brukte pouchen fra instrumentet. Legg den i en plastpose som knytes igjen og kastes i egen beholder for risikoavfall under instrumentet. MERK: Det er svært viktig at det ikke blir stukket hull på pouchen ved at andre ting kastes oppå pouchen i søppelboksen.
Svarrapportering og godkjenning av svar
FilmArray kommuniserer med Beaker, og alle resultat kommer automatisk over når svaret foreligger med ulike fastkommentarer ut fra ulike svar (se under).
Ta telefonisk kontakt med avdelingen og informer at en foreløpig identifisering foreligger for positiv blodkultur. Dette dokumenteres i Beaker ved å legge inn i kommunikasjonslogg.
Fastkommentar i Beaker hvor det er detektert mikrober (*):
- Resultatet er veiledende og skal tolkes i sammenheng med resultater fra identifisering og res. bestemmelse utført ved Lab. for med. mikrobiologi, Levanger. (automatisk kommentar)
(*) Unntak: Hvis detektert
mikrobe er Staphylococcus spp. vil bare artene Staph.
aureus og Staph.lugdunensis svares
ut. Andre Staphylocoocus enn Staphylococcus
aureus og Staphylococcus lungdunensis, vil besvares med «se merknad»
+ fast kommentar:
Ingen sikre mikrober påvist. Blodkulturen dyrkes ved Sykehuset Levanger. Ved
eventuelle funn gis rekvirent telefonisk beskjed. (automatisk kommentar)
Tilleggskommentar ved påvisning av Salmonella spp, Candida auris, Cryptococcus neoformans/gatti:
- Smitteverntiltak må vurderes. (ikke automatisk kommentar)
Tilleggskommentar ved påvist resistensmekanisme (Applicable Antimicrobial Resistance Genes Detected):
- Det er påvist en resistensmekanisme for dette isolatet. Smitteverntiltak må iverksettes. Ved spørsmål, ta kontakt med seksjon for medisinsk mikrobiologi, Levanger." (automatisk kommentar)
Fastkommentar ved negativt svar (ingen mikrobe er detektert):
-
Besvares som «Se merknad».
Ingen sikre mikrober påvist. Blodkulturen dyrkes ved Sykehuset Levanger. Ved
eventuelle funn gis rekvirent telefonisk beskjed. (automatisk
kommentar)
Tilleggskommentar ved påvisning av Candida Tropicalis:
- Pga. Forekomst av falske positive Candida Tropicalis legges det inn en LABKOMMENTAR på disse resultatene, slik at det er sporbart i Beaker hvorfor det er holdt tilbake. Bruk smartphrase .CATR: Kjent kontaminasjonsproblematikk med C. tropicalis hos produsent av blodkulturflasker (BD). Påvist C. tropicalis på FilmArray holdes tilbake inntil vurdering av grampreparat og videre dyrkning bekrefter funn. (ikke automatisk kommentar)
- Besvarelse: Rapporter ut alle andre funn enn C. tropicalis.
Vedlikehold
Hver 14 dag
- Reset instrumentet vha. knapp på instrumentets høyre bakside.
Kvartalsvis
- Påfyllingsstasjonen: Lag en 10% klorløsning (husholdningsklor). Tørk over påfyllingsstasjonen med en klut fuktet med klorløsningen. Skyll av påfyllingsstasjonen med destillert vann og legg til tørk.
- Tørk med en klut fuktet med 75% desinfeksjonssprit på instrumentet.
Halvårlig
- Filteret i analysestasjonen støvsuges.
Dekontamineringsprosedyre ved synlig søl eller pouchlekkasje
Dekontaminering ved pouchlekkasje
Hvis en pouch lekker, må følgende forholdsregler tas for å unngå kontaminering:
1. Ta på rent personlig verneutstyr, som en gul laboratoriefrakk og hansker.
2. Påse at ingen bruker instrumentet eller de potensielt kontaminerte områdene før dekontamineringen er fullført.
3. Dekontaminer instrumentet og arbeidsområdet og kast pouchen med bruk av følgende trinn:
4. Kast potensielt kontaminerte hansker og ta på rene hansker.
5. Kast en potensielt kontaminert laboratoriefrakk og ta på en ren laboratoriefrakk.
6. Kast pouchen med lekkasje i en beholder for biologisk risikabelt avfall.
7. Skift hansker.
8. Rengjør instrumentet og de berørte arbeidsområdene ved å følge retningslinjene nedenfor.
Lag en klorløsning 10% (en del klorin og ni deler vann)
Dekontaminering av pouchpåfyllingskammeret, instrumentets utside
1. Fukt et papirhåndklede og tørk av alle utvendige flater på instrumentet. Skift hansker.
2. Gjenta trinn 1 to ganger.
3. Skift hansker. Fukt nytt papirhåndkle med destillert vann og tørk over. Gjenta punkt 3 en gang.
Dekontaminering av benkeplate etc.
1. Ta på rent personlig verneutstyr, som en gul laboratoriefrakk og hansker.
2. Spray klorløsning på området som kan være kontaminert. La løsningen virke i minst tre minutter for at løsningen skal reagere med eventuelle kontaminanter på flatene.
3. Tørk av området med et rent papirhåndkle. Skift hansker.
4. Gjenta trinn 2 og 3 to ganger, slik at du tørker av totalt tre ganger.
5. Skift hansker. Spray området med destillert vann.
6. Tørk området tørt med et nytt papirhåndkle. Skift hansker.
7. Spray området med virkon eller et tilsvarende produkt. Følg produktets bruksanvisning. Skift hansker.
8. Skyll området ved å spraye det med destillert vann og tørk det med papir.
Sjekke funksjonen til et dekontaminert instrument vha. en negativ prøve. Bruk vann som prøve. Hvis kjøringen er vellykket og alle resultater er negative, kan du fortsette å bruke instrumentet som normalt. Hvis det oppnås uventede, positive resultater eller kjøringen mislykkes, kontakte du med. ansvarlig på Mikrobiologen på Levanger.