Arbeidsbeskrivelse
ANSVAR
Spesialbioingeniør, faggruppe I, har ansvar for vedlikehold av denne prosedyren. Alle bioingeniører som er opplært i denne prosedyren har ansvar for at prosedyren blir fulgt.
ARBEIDETS GANG
Analyseutstyr og klargjøring av disse
Referansestammer og medier som brukes til daglig kontroll: Se tabell 2
Tabell 2:
|
Referansestamme |
Medier |
|
ESCO ATCC 25922 |
MH-agar |
|
STAU CCUG 15915 |
MH-agar |
|
ENFÆ ATCC 29212 |
MH-agar |
|
HAIN ATCC 49766 |
MH-agar med β-NAD |
|
ESCO CCUG 30600 |
MH-agar |
|
PSAE ATCC 27853 |
MH-agar |
Antibiotikalapper fra Oxoid: Resistenslappene består av 6 mm i diameter tynne papirlapper impregnert med en spesifikk konsentrasjon av et antibiotikum. De oppbevares i kjølerom RTB024.
Feilkilder og interferens
· For høy eller lav suspensjon
· Urent bakterieisolat
· Feil agardybde
· Antibiotikalappen legges på for sent. På inokulerte resistensskåler som blir stående for lenge i romtemperatur kan bakteriestammen begynne å vokse, noe som kan føre til falske for små soner.
· For sen inkubering. Hvis resistensskålene blir stående i romtemperatur etter at lappene er påført, kan pre-diffusjon gi falske store soner.
· Agarskåler og saltvann har ikke blitt romtemperert
· Fuktige agarskåler
· Holdbarheten på antibiotikalappene
· For mange skåler i høyden. Kan gi ujevn fordeling av temperatur.
· Inkubering over det anbefalte tidsintervallet kan føre til vekst inni sonene og det vil være fare for at isolater blir rapporter som falsk resistent.
Fremgangsmåte/Utførelse av analysen/Ansvarsområde
Klargjøring av antibiotika:
Spesialbioingeniør, faggruppe I, har ansvar for at det er laget bokser med alle de antibiotikarørene som skal byttes ut i stemplene.
Det lages for 5 uker av gangen hvor lotnummer lagres som bilder i mappen SPORING AV ANTIBIOTIKA I BRUK STEMPEL . Antibiotikalappene er holdbare i 7 dager etter at de er åpnet. Disse byttes ut hver tirsdag av den som har VH-oppgaver. Tørkestoffet i dispensere og i antibiotikaboksen byttes ut en gang i uken. Dette gjøres hver torsdag av den som har VH-oppgaver. Se Vedlikeholdsskjema i mappen Vedlikehold.
Fordeling, opptak og subkultivering av referansestammer:
For stammebanktansvarlig:
Referansestammene som brukes til resistenskontroll oppbevart ved – 80 °C i fryser RBT019.8 rom B019, og tas opp fra nedfrosset referansekultur, hver 8. mandag. Se ALM-MM-Bakt; Etablering og drift av Stammebank. Oppformerte stammer fordeles i 8 kryorør med Greaves som oppbevares i egen boks merket med Ukentlige kontrollstammer og oppbevares i fryser RBT019.8 rom B019.
K-oppgaver:
Kontrollstammer som benyttes til kontrollering av antibiotika skal subkultiveres daglig før bruk. K-oppgaveansvarlig gjør dette mandag til onsdag, slik at subkulturer som benyttes til oppsett ikke er eldre enn 24 timer. Ved spredning av stammen skal det plukkes flere kolonier (5-10) for å unngå å plukke en mutant. Skålene merkes med kontrollstammeetikett og dato (de samme som vi bruker ved oppsett av resistenskontroller).
Den som har k-oppgaver på fredag har ansvar for å klargjøre spredningsskåler til søndagsvakt. Skåler skal stå ferdig merket på trallen på prøveplassen. Skålene merkes med kontrollstammeetikett og dato (de samme som vi bruker ved oppsett av resistenskontroller)
Søndagsvakt:
Bioingeniør med søndagsvakt skal ta opp kryorør med stammene som skal brukes til resistenskontroll den kommende uken og spre til de klargjorte skålene. Husk å påfør dato.
Daglig kontrollering:
Antibiotika i stempel, samt noen enkelte antibiotika i boksen skal kontrolleres mandag til torsdag (avlesning tirsdag til fredag) med samme metode som i den daglige rutinen. Se ALM-MM-Res; Resistensoppsett med agardiffusjonsteknikk og Oxoid-lapper. Registreringsskjema ligger i mappen Kontroller på Teams. ESCO ATCC 25922 Urin GRNS 1, 2 og 3 og STAU CCUG 15915 staph 1 og 2 skal også leses av med Biomic og har egne kontroll skjema på Teams. Se ALM-MM-Res; Bruk og vedlikehold av Biomic
Ukentlig kontrollering:
Resterende antibiotika i boksen skal kontrolleres hver torsdag. Dette skal utføres av den som har K-oppgaver.
Oversikt over kontroller ligger under relatert. Registreringsskjema ligger i mappen Kontroller (under ukentlig kontroll av boksen).
Kontrollering ved behov:
Antibiotika som settes opp sjelden (M3 eller NEQAS) skal kontrolleres når de åpnes. Utføres av den som skal benytte middelet. Husk å noter på pasientprøven middelet skal benyttes på at det skal leses av kontroll dagen etter. Oversikt over hvilke midler dette gjelder ligger under relatert. Resultatene registreres i RESISTENSKTR. Antibiotikalapper, i mappen mottakskontroll av antibiotikalapper.
Avlesning:
Hver arbeidsstasjon har ansvar for at daglige resistenskontroller for deres materialgruppe blir avlest og vurdert. Dette skal gjøres før kliniske isolater rapporteres. Den som har ansvar for urinprøvene skal lese av ESCO ATCC 25922 Urin GRNS 1, 2 og 3 og STAU CCUG 15915 staph 1 og 2 med Biomic. Den som har ansvaret for K-oppgaver på fredag har ansvar for å lese av og vurdere ukentlig kontrollering av antibiotika i boksen.
Kontroller som settes opp etter behov vurderes av den som vurderer prøven middelet skal besvares på.
Vurdering av svar
Sonediameteren skal ligge innenfor gitte grenseverdier. Sonene leses av og skrives inn i excelark i mappen Kontroller i Teams. Noter hva som kan være mulig årsak dersom et middel havner utenfor de gitte grenseverdiene under kommentar/vurdering.
For hver gang kontrollene er satt opp så skal de 20 siste resultatene vurderes. Undersøk resultatene for trender og for soner som konsekvent er over eller under målverdien.
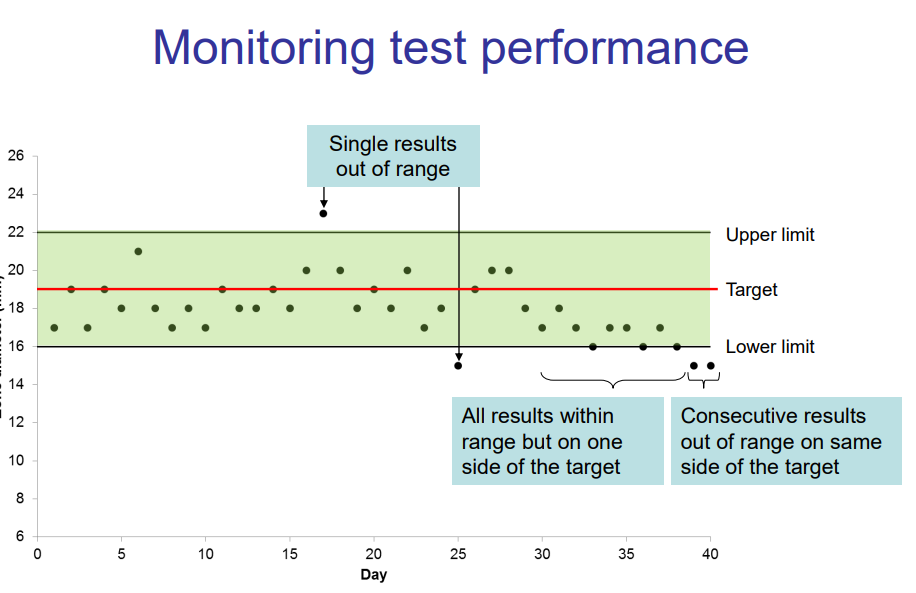
Aksjonsgrenser:
· Hvis to ikke påfølgende kontrollsoner av 20 tester er utenfor målområdet - Resistensbestemmelse på kliniske prøver rapporteres, men må undersøkes nærmere.
· Hvis to påfølgende kontrollsoner av 20 tester er utenfor målområdet - Undersøk nærmere før resistensbestemmelse på kliniske prøver rapporteres. Ta kontakt med fagbioingeniør eller spesialbioingeniør. Det er mulig testene må repeteres.
· Hvis flere antibiotikalapper (>2) er utenfor målområdet på samme dag - Undersøk nærmere før resistensbestemmelse på kliniske prøver rapporteres. Ta kontakt med fagbioingeniør eller spesialbioingeniør. Det er mulig testene må repeteres.
· Dersom kontrollstammer som skal være resistent på et antibiotika, ikke blir det ved kontrolloppsett, så må alle kliniske isolat holdes tilbake. Gjennomfør feilsøking og retest kontrollstammen og kliniske isolat.
· Hvis kontrollsonen ikke er nær EUCAST sitt mål gjentatte ganger. Minst 2 tidligere resultater av de siste 20 målingene er > 1 mm fra målet OG på samme side (enten under eller over målet) - Ta kontakt med fagbioingeniør eller spesialbioingeniør. Kliniske isolater skal ikke rapporteres før det foreligger en konklusjon fra medisinskfaglig ansvarlig. Gjenta kontroll for den individuelle stamme/antibiotikakombinasjonen og sjekk effekten dette har på kliniske isolater.
Når mulige feilkilder ved resistensbestemmelsen skal undersøkes skal man vurdere problemer med antibiotikalappene, medier, testforholdene og kvaliteten på kontrollstammen. Se tabell 3 for mulige feilkilder.
Tabell 3:
|
Mulige feilkilder |
|
|
Medium |
Feil lagring av agarskålene |
|
Agaren er ikke laget etter standard (Dette skal ha blitt kontrollert av leverandør) |
|
|
Batch til batch variasjon eller endret leverandør |
|
|
pH |
|
|
Agardybde eller agarvolum |
|
|
Utgått på dato |
|
|
Testforhold |
15-15-15 minutters regelen er ikke fulgt |
|
Inkubasjon (riktig temperatur, atmosfære og inkubasjonstid) |
|
|
Feil inokulering (for tynn, for tykk eller ujevn) |
|
|
Avlesningsforhold (bakgrunn, lys) |
|
|
Avlesning av sonekant |
|
|
Antibiotikalapper |
Feil antibiotikalapp (Feil antibiotika eller feil styrke) |
|
Antibiotikalappens virkning (Feil oppbevaring, ustabilt antibiotika, utgått på dato) |
|
|
Antibiotikalappene hadde ikke fått romtempratur før beholderen ble åpnet |
|
|
For mange antibiotikalapper på en agarskål (interferens mellom antibiotika) |
|
|
Kontrollstamme |
Feil kontrollstamme |
|
Mutasjon |
|
|
Kontaminering |
|
|
Gammel kontrollstamme |
|
Årlig trendvurdering
Årlig trendvurdering gjøres av spesialbioingeniør, faggruppe I, i starten av januar for foregående år. Dette skal vurderes og dokumenteres av faggruppen i samarbeid med medisinsk faglig ansvarlig, og en enkel konklusjon skal dokumenteres under hver vurdering.
Det skal registreres middelverdi og median for alle referansestammer/antibiotikakombinasjoner hvor det blir utført daglig kontroll. Målet er at medianen skal være ± 1 mm fra målverdien. Resultatene ligger i egne EQS-dokument.
Dersom det er flere medianer som er > 1 mm fra målverdien på samme side, enten over eller under målverdien, for flere stammer eller antibiotikakombinasjoner, bør det undersøkes om det kan skyldes agaren som er brukt eller om det er en systematisk feil ved avlesning av soner.
Ved mistanke om systematisk feil ved avlesning av soner bør det gjennomføres en øvelse hvor alle leser av soner på samme resistensskål, for så å se om sonene er normalfordelt. Målet er ±3 mm fra målverdien.
For kombinasjoner av stammer eller antibiotika med median >1 mm fra målet, bør det sammenlignes med medianen for distribusjonen for kliniske isolater av samme art med medianen for EUCAST-referansefordeling EUCAST villtype distribusjon for å se om det er et skifte også for kliniske isolater.
Det kan være behov for å gjøre trendvurdering utenom den årlige, dersom det er soner som er utenfor området, eller gjentatte ganger er ved nedre eller øvre grense. Det bør da sjekkes hvilken effekt dette har på kliniske isolater.
Årlig internundervising og harmonisering
Det skal gjennomføres internundervisning og harmonisering november/desember hvert år og det skal være et krav i kompetanseportalen at dette er gjennomført. Dersom man ikke har fått gjennomført internundervisning og harmonisering skal man lese gjennom denne prosedyren, ALM-MM-Res; Agargradient metode og Manual EUCAST Disk Test . Dette skal også dokumenteres i kompetanseportalen.
Internundervisning: Gjennomfør internundervisning i resistensoppsett jfr. prosedyre: ALM-MM-Res; Resistensoppsett med agardiffusjonsteknikk og Oxoid-lapper og ALM-MM-Res; Agargradient metode. Det blir etterspurt ønskede problemstillinger før undervisningen.
Faste tema hvert år:
· Feilkilder
· 15-15-15 minutter-regel
· Ulike avlesningshensyn som bør tas jfr. tabell i ALM-MM-Res; Resistensoppsett med agardiffusjonsteknikk og Oxoid-lapper
· Avvlesning av vancomycin på enterokokker. Bruk ENFÆ, VAN B ATCC 51299 (med lavgradig vancomycinresistens) og ENFÆ ATCC 29212 for å sammenligne
· Små Gram negative staver i blodkultur og håndtering av slike situasjoner
· Avlesning av bakterocide og bakteriostatiske mider ved MTS
Harmonisering: Alle som er opplært til å sette opp resistensbestemmelse skal gjennom en test hvor man skal ha fokus på hele prosessen. Noter tidspunkt stammen blir slemmet opp og hvilket densitometer som er brukt. Det skal være nøyaktig 0,5 McFarland. Alle skal så lese av alle resistensbestemmelsene for å kunne sammenligne og eventuelt kunne avdekke diskrepans ved oppsett eller avlesning.
Til harmonisering plukkes det ut to av stammene som brukes til daglige kontroller, se tabell 1.