INNLEDNING
|
Enhet, faggruppe |
Medisinsk biokjemi, ALM, HNT. Faggruppe 1, Hematologi/koagulasjon |
|
Instrument |
Sysmex XN-1500 |
|
Parameter |
B-EPK, B-Hb, B-EVF, B-MCV, B-MCH, B-LPK, B-Nøytrofile, B-Lymfocytter, B-Monocytter, B-Eosinofile, B-Basofile, B-TPK, B-Retic, B-Ret-He, B-Hypo-He SP-/AV-/PV- /LV-/DI-EPK, -LPK, -Mononukleære celler, |
|
Prøvematerialer |
Blod (B), spinalvæske (SP), ascitesvæske (AV), pleuravæske (PV), leddvæske (LV), dialysat (DI) Blodprodukt (Erytrocyttkonsentrat, plasmakontroller og trombocyttkonsentrat) |
Valideringsdokumentasjonen består av:
- ALM-; Validering av produkt, metoder og utstyr
- Endringsmelding, se Meldeskjema HNT: Innkjøp av hematologiutstyr
- Forhåndsvurdering inkludert dokumentasjon medsendt fra firma.
Se Relatert - Valideringsplan,
med krav til de valideringsparametere som en vurderer må valideres med forsøk i eget laboratorium. - Dokumentasjon, vurdering og godkjenning av egne forsøk.
- Oppfølging
Etter anbudsrunde blir Celldyn Sapphire byttet ut med Sysmex XN-1500 DI på Levanger og Sysmex XN-1500 i tillegg til DC 1 på Namsos.
Mellomvareløsningen Extended IPU skal benyttes til validering av resultat.
XN-1500 = XN 20 og utstryks- og fargemaskin
DI 60 = Cellavision / digital morfologi
DC 1 = Cellavision / digital morfologi
FORHÅNDSVURDERING
Forhåndsvurderingen er gjort i henhold til beskrivelser i endringsmelding og kravspesifikasjon. (Vedlegg 4)
KLINISK NYTTEVERDI
Referansegrenser/Beslutningskriterier
Pga. overgang til ny kalibrator (Abbott Hem-Cal til Sysmex XN CAL og XN CAL PF) blir det behov for å endre referansegrenser. Dersom instrumentet oppfyller kravene til riktighet, ved kalibrering med XN CAL, hentes disse fra St.Olavs Hospital som også har Sysmex som hovedinstrument, altså samme instrument og kalibrator. Referansegrensene der ble sist gjennomgått i januar 2018. (5)
Beslutningskriterier er hentet fra valideringsrapporten av Sysmex XN-1000. (4)
PRAKTISK EGNETHET
Analyseinstrument, reagenser og kalibratorer
Laboratoriene har hatt Sysmex XN-1000 siden 2015.
Instrumentet er derfor kjent for de ansatte, og det trengs mindre ressurser til opplæring. Med to instrument av samme type kan reagens og kontroller utnyttes maksimalt. Holdbarheten på prøvematerialet er bedre enn på Celldyn Sapphire. Instrumentene vil fungere som backup for hverandre på alle analyser.
Automatisert utstryks- og fargemaskin vil standardisere tillagingen av blodutstryk. I kombinasjon med Cellavision vil ferdig mikroskoperte blodutstryk bli tilgjengelig for vurdering tidligere enn før.
Kontrollmaterialer
Leveres av Sysmex.
HMS/Miljø
Risikovurdering av instrumentet / reagensene, med tanke på HMS blir beskrevet i EcoOnline. (Vedlegg 10)
Kalibrering
I forkant av datainnsamling kaliberes XN-1500 med Sysmex kalibratorene XN CAL og XN CAL PF, levert av Sysmex
ANALYTISK KVALITET
Riktighet og presisjon
Våre krav til riktighet og presisjon oppfylles ifølge produsenten. (Vedlegg 6)
Måleusikkerhet
Vi oppgir analytisk usikkerhet til våre rekvirenter, i form av en analytisk variasjonskoeffisient. I tillegg til dette kan det foreligge preanalytiske feilkilder som gjør den totale måleusikkerheten større. Derfor oppgir vi også en variasjonskoeffisient som viser samlet analytisk og normal innen-person biologisk variasjon.
For å gjøre disse usikkerhetsmomentene minst mulig, følger vi våre rutiner beskrevet i ALM-MB-Pre; Prosedyreoversikt for Preanalytiske faktorer, Cobas og proteiner og ALM-; Kvalitetshåndboken til Avdeling for Laboratoriemedisin, HNT.
VALIDERINGSPLAN
Etter forhåndsvurdering, gjennomgang av pakningsvedlegg og tilsendt dokumentasjon, vil punktene nevnt under utføres. Dette blir gjort i henhold til interne prosedyrer laget for Sysmex XN-1000 og anbefalinger i instrumentets manualer.
Riktighet
Instrumentets riktighet vurderes ved analysering av kommersielle fullblodskontroller i 3 nivå (XN-CHECK) og body fluid-kontroller i 2 nivå (XN-CHECK-BF.) Kontrollene analyseres 4 ganger per dag i 20 dager.
Kravet er at riktigheten er innenfor det som er oppgitt av produsenten. (1) Interferens, analytisk spesifisitet og holdbarhet er dokumentert i Validering av XN-1000. (4)
Celldyn Sapphire er sporbar til Hem-Cal fra Abbott og Sysmex XN-1500 blir sporbar til Sysmex XN CAL. For å dokumentere nivåforskjellen mellom kalibratorene skal det analyseres 40 pasientprøver (enkeltprøver) på Celldyn Sapphire og Sysmex XN-1500 i løpet av noen dager. Det vil bli utført regresjonsanalyse på dataene.
Meanverdiene på de to siste SLP for Sysmex XN-1000 regnes om ved hjelp av nivåforskjellen mellom instrumentene. Dette for å se at verdiene som beregnes for Sysmex kalibrert med XN CAL havner innenfor akseptable grenser oppgitt av Noklus i sin metodegruppe. (Første utsendelse av SLP er 19/3-19.)
Det utføres også en samkjøring mellom XN-1000 og XN-1500 når begge instrumentene er kalibrert med samme kalibrator (Sysmex XN CAL og XN CAL PF). Det blir analysert 3 pasientprøver x 10 og meanverdier sammenlignes.
Krav: Forskjellen mellom instrumentene bør være mindre enn 1 analytisk standardavvik for hver analyse.
Presisjon
Instrumentets upresisjon vil også bli estimert ut fra kommersielle kontroller; analysert 4 ganger per dag i 20 dager.
Kravet er at reproduserbarheten skal være innenfor det som er oppgitt av produsenten.
Morfologiske flagg
Henviser til Validering av XN-1000. (4)
Data/IKT
Resultatene fra instrumentet skal vurderes/valideres i mellomvareløsningen Extended IPU. Det skal kontrolleres at dataoverføringene til og fra instrumentet fungerer som tiltenkt. Til dette benyttes 5-10 prøver.
Funksjonen av Extended IPU vil bli validert for seg selv, som et tillegg til valideringsrapporten. Dette innebærer kontroll av at reglene som er lagt inn fungerer som tiltenkt (reanalysering pga meldinger/verdier, svar som må undersøkes videre holdes tilbake, blodutstryk blir laget) og at dataoverføringene herfra er riktig.
Behandling av blodutstrykene i Cellavision, og overføring av svar derfra, vil også bli behandlet i en egen valideringsrapport.
DOKUMENTASJON og DISKUSJON
Innsamling av data til valideringen ble gjort i januar og februar 2019.
HMS/Miljø
Instrument og reagenser er CE-merket.
Reagensene som benyttes til analysering er risikovurdert og finnes i EcoOnline. (Vedlegg 10).
Fluorcell RET, Fluorcell WDF og Cellclean er faremerket med moderat helserisiko.
Rester av Fluorcell kastes i risikoavfallsboks. De er også omtalt i valideringen av XN1000.
Fargereagensene til SP er helseskadelige og brannfarlige. Det må brukes hansker ved bytte av reagens. Innholdet i avfallsdunken leveres som eget avfall, blir tatt hånd om av portørene ved sykehuset, og avhendes etter gjeldende regler.
Kalibrering
Instrumentene (Sysmex XN-1500) ble kalibrert før innkjøring:
XN CAL og XN CAL PF Lot 8365 2101. Kalibrering ble utført 14/1-19 på Levanger og 17/1-19 på Namsos.
Riktighet og Presisjon
Kommersielle kontroller XN CHECK og XN-CHECK-BF ble analysert 4 ganger pr dag i 20 dager. (Fullblod – 3 nivå og BF – 2 nivå). Resultatene for fullblodskontrollene er presentert i tabell 1-6.
Body Fluid blir ikke presentert, da XN-1500 og XN-1000 benytter akkurat samme analysemetode og analyseres i samme kanaler som fullblod. I valideringen av XN-1000 ble Body Fluid evaluert og godt dokumentert (4). Tilgangen på egnede prøvematerialer til samkjøring har ikke vært tilstede i valideringsperioden.
Oppnådd Bias og CV på XN-1500 mot krav satt i kravspesifikasjonen
Som fasitverdi er det brukt oppgitte verdier (nivå) på kontrollene. Disse er levert av Sysmex og verdiene satt etter kalibrering med Sysmex XN CAL.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabell 1: Vurdering av oppnådd Bias og CV fullblod nivå 1 på XN-1500 mot krav satt i kravspesifikasjonen (Vedlegg 6).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabell 2: Vurdering av oppnådd Bias og CV fullblod nivå 2 på XN-1500 mot krav satt i kravspesifikasjonen (Vedlegg 6).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabell 3: Vurdering av oppnådd Bias og CV fullblod nivå 3 på XN-1500 mot krav satt i kravspesifikasjonen (Vedlegg 6). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabell 1, 2 og 3 viser data fra analyseringen av XN Fullblodskontroller nivå 1, 2 og 3. Disse ble analysert 4 ganger per dag i tidsrommet januar - februar 2019.
Resultatene viser at alle parametere kom innenfor kravene til både Bias og CV satt i kravspesifikasjonen (Vedlegg 6). MCV og HCT nivå 2 og 3 Levanger kom akkurat utenfor Bias-kravet men på bakgrunn av at avvikene er såpass små, og at MCV er en kalkulert parameter, er begge vurdert som OK.
Kontrollmaterialet for Retic og Ret-He er ikke stabilt gjennom hele holdbarhetsperioden. Avviket mellom CV nivå 3, Levanger, og krav til CV er lite, og uten klinisk betydning..
Ret-He har ikke oppgitt biologisk variasjon i Westgards database (7). Vurderingen av Bias er derfor gjort faglig i samråd med A. Åsberg; valgt samme Bias som Hb. Både Namsos og Levanger har bias på samme side på alle sine kontroller. Ret-He kalibreres ikke med kalibrator, men faktor kan justeres manuelt, og bias vil derfor være eliminert før instrumentene settes i rutinedrift.
Holdbarheten på Hypo-He er kort, dette gjelder også i kontrollmaterialet.; erfaring viser at Hypo-He stiger opp til 40 % i løpet av holdbarhetsperioden. Bias for Hypo-He faller derfor langt utenfor kravene, og kan ikke godkjennes ut fra dette.
Oppnådd Bias og CV vurdert mot oppgitt Bias og CV fra produsent
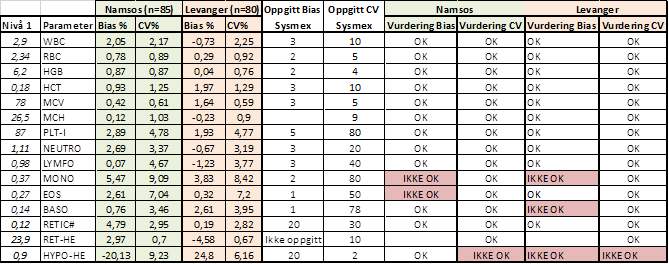
Tabell 4: Vurdering av oppnådd Bias og CV fullblod nivå 1 mot oppgitt Bias og CV fra Sysmex (1).
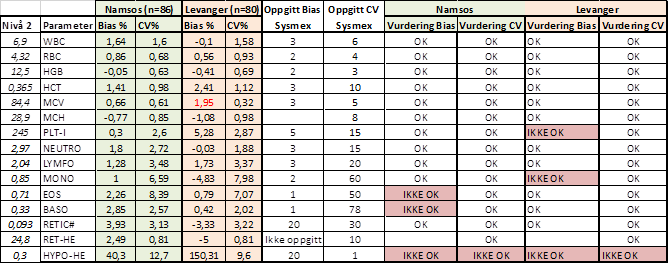
Tabell 5: Vurdering av oppnådd Bias og CV fullblod nivå 2 mot oppgitt Bias og CV fra Sysmex (1).
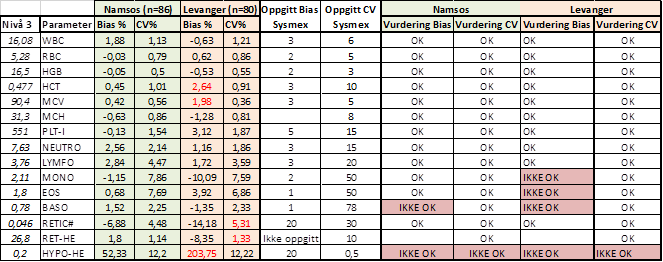
Tabell 6: Vurdering av oppnådd Bias og CV fullblod nivå 3 mot oppgitt Bias og CV fra Sysmex (1).
Tabell 4, 5 og 6 viser oppnådd Bias og CV vurdert mot oppgitt Bias og CV fra produsent.(1) Alle parametere unntatt Hypo-He er innenfor oppgitt CV fra Sysmex. Videre diskusjon vil derfor ta for seg vurderingen av Bias på de parameterne som ikke oppfylte kravet.
Hypo-He vil bli diskutert til slutt.
PLT-I: OK Bias på alle nivå i Namsos, men faller utenfor med Bias på 5,28% på Levanger. Oppgitt fra Sysmex er 5,1 %. Forskjellen er minimal og den vil være av liten klinisk betydning.
MONO: Sysmex oppgir Bias ± 2% på alle nivå. Namsos oppnår lik Bias på nivå 2 og 3, men ikke nivå 1. På Levanger blir Bias høyere på alle nivå. Alle nivå kommer vel innenfor kravene basert på biologisk variasjon (19,83 %) og vurderes derfor gode nok til sitt bruksområde.
EOS: Sysmex oppgir Bias på 1% på alle nivå. På Levanger kommer nivå 3 utenfor, det samme gjør nivå 1 og 2 på Namsos. Bias på 1% er veldig lavt og det skal liten variasjon i prøveresultatene for at de faller utenfor. Eosinofile er også ofte tilstede i lave konsentrasjoner slik at små variasjoner vil få store utslag på % Bias. Kravene for Eosinofile basert på biologisk variasjon er 29,71% og ifht til dette kravet kommer alle nivå vel innenfor og vurderes derfor til gode nok til sitt bruksområde.
BASO: Det samme gjelder for Basofile. De er ofte tilstede i lave konsentrasjoner slik at små variasjoner vil få store utslag på % Bias. Også her oppgir Sysmex Bias på 1%, det er veldig lite med tanke på at kravene basert på biologisk variasjon er 23.08%. Dette kravet kommer alle nivåene både i Namsos og Levanger godt innenfor.
Interferens og analytisk spesifisitet er dokumentert i Validering av XN-1000. (4)
Vi benytter holdbarhetsstudie utført ved SOH, sist revidert januar-18. (12)
Nivåforskjellen mellom Celldyn Sapphire og Sysmex XN-1500
40 tilfeldig valgte pasientprøver ble analysert i tidsrommet januar – februar 2019. Resultatene er dokumentert i tabell 7-12.
|
|
|
|
p-verdi fra to-sidig t-test |
Signifikant forskjell p < 0.05 |
|
Parameter |
Regresjonslinje |
Korrelasjonskoeffisient |
||
|
WBC |
y = 1,0036x - 0,0993 |
0,9937 |
0,79 |
Nei |
|
RBC |
y = 1,0215x - 0,0702 |
0,9766 |
0,89 |
Nei |
|
Hb |
y = 0,9563x + 0,6512 |
0,9963 |
0,86 |
Nei |
|
HCT |
y = 1,0645x - 0,0273 |
0,9727 |
0,64 |
Nei |
|
MCV |
y = 1,0266x - 3,3907 |
0,9579 |
0,48 |
Nei |
|
MCH |
y = 0,8205x + 5,4817 |
0,8526 |
0,31 |
Nei |
|
PLT-I |
y = 1,1127x - 13,844 |
0,9878 |
0,64 |
Nei |
|
NEUT % |
y = 0,9897x - 0,0665 |
0,9925 |
0,75 |
Nei |
|
LYMPH % |
y = 1x + 1,01 |
0,9906 |
0,63 |
Nei |
|
MONO % |
y = 1,0011x - 0,3001 |
0,8938 |
0,69 |
Nei |
|
EOS % |
y = 0,9774x + 0,2018 |
0,924 |
0,68 |
Nei |
|
BASO % |
y = 0,596x + 0,2304 |
0,2322 |
0,68 |
Nei |
|
RETIC # |
y = 0,8995x + 0,0063 |
0,9134 |
0,61 |
Nei |
Tabell 7: Nivåforskjell mellom Celldyn Sapphire og Sysmex XN-1500 i Namsos.
|
Parameter |
Regresjonslinje |
Korrelasjonskoeffisient |
p-verdi fra to-sidig t-test |
Signifikant forskjell p < 0,05 |
|
WBC |
y = 1,0151x - 0,482 |
0,9873 |
0,89 |
Nei |
|
RBC |
y = 1,979x + 0,1723 |
0,9871 |
0,46 |
Nei |
|
Hb |
y = 0,9632x + 0,8009 |
0,9919 |
0,37 |
Nei |
|
HCT |
y = 0,9925x +0,0028 |
0,9797 |
0,58 |
Nei |
|
MCV |
y = 0,9916x - 0,9806 |
0,9636 |
0,09 |
Nei |
|
MCH |
y = 0,9311x + 2,2354 |
0,8750 |
0,66 |
Nei |
|
PLT-I |
y = 0,9676x + 0,8918 |
0,9732 |
0,87 |
Nei |
|
NEUT % |
y = 1,0077x - 0,7533 |
0,8660 |
0,9 |
Nei |
|
LYMPH % |
y = 0,9927x + 1,0784 |
0,9849 |
0,7 |
Nei |
|
MONO % |
y = 0,8575x + 0,8726 |
0,8938 |
0,08 |
Nei |
|
EOS % |
y = 1,0092x + 0,0259 |
0,9739 |
0,92 |
Nei |
|
BASO % |
y = 0,7076x + 0,2441 |
0,3469 |
0,4 |
Nei |
|
RETIC # |
y = 1,0852x - 0,002 |
0,8466 |
0,43 |
Nei |
Tabell 8: Nivåforskjell mellom Celldyn Sapphire og Sysmex XN-1500 i Levanger.
For å kunne dokumentere nivåforskjellene mellom de to forskjellige kalibratorene som brukes på hhv Sysmex og Celldyn ble det ut fra 40 pasientprøver sett på den lineære sammenhengen samt gjort to-sidig t-test for å evaluere om det er signifikant forskjell.
Som presentert i tabell 7 og 8 var det ingen statistisk signifikant forskjell i gjennomsnitt for noen av parameterne. Regresjonslinjene viser også at de to instrumentene gir resultater i omtrent samme nivå. For MCH er korrelasjonskoeffisienten lavere enn for de andre parameterne, noe som kan skyldes at spredningen i resultatene var relativt mindre. Regresjonslinjen er derfor også mer usikkert estimert. Det samme kan være tilfelle for basofile. For basofile vil ulikheter i metodenes celledifferensiering også spille en rolle. Ret-He kunne ikke sammenliknes fordi Celldyn ikke har en tilsvarende parameter.
Hypo-He er ikke tatt med i vurderingene her, da de fleste pasientene har så lav verdi at det ikke gir verdifull informasjon i denne sammenhengen.
Sysmex kalibrator (XN-CAL) ifht akseptable grenser oppgitt av Noklus.
Tabell 9-12 viser hvilke verdier vi ville fått på de aktuelle SLPene dersom XN-1000 var kalibrert med Sysmex-kalibrator (XN-CAL) og ikke Celldyn kalibrator. Den prosentvise metodeforskjellen er beregnet ut fra nivåforskjellen mellom Celldyn og Sysmex målt på 7 SLPer i 2017 og 2018.
Namsos brukte SLP nr. 2 i stedet for 3 da det var sendt inn feil resultater på nøytrofile på SLP nr.3.
|
Levanger |
3/2018 |
Metodeforskjell (%) |
Beregnet verdi |
Akseptabelt område |
Vurdering |
|
LPK |
5,95 |
0,64 |
5,99 |
5,54 - 6,77 |
OK |
|
EPK |
3,825 |
0,11 |
3,829 |
3,736 - 4,130 |
OK |
|
Hb |
12,2 |
-1,91 |
11,97 |
11,16 - 12,34 |
OK |
|
EVF |
0,35 |
-1,57 |
0,34 |
0,315 - 0,385 |
OK |
|
MCV |
91,9 |
-1,36 |
90,7 |
80,33 - 98,18 |
OK |
|
MCH |
31,9 |
-2,09 |
31,2 |
26,87 - 32,84 |
OK |
|
MCHC |
34,7 |
-0,51 |
34,5 |
30,24 - 36,96 |
OK |
|
TPK |
210 |
-0,75 |
208 |
184 - 276 |
OK |
|
Nøyt |
51,30 |
0,50 |
51,55 |
44,4 - 60,7 |
OK |
|
Lymf |
33,75 |
-1,57 |
33,22 |
27,84 - 37,66 |
OK |
|
Mono |
9,35 |
3,82 |
9,71 |
6,76 - 12,55 |
OK |
|
Eos |
4,80 |
-3,00 |
4,66 |
2,30 - 6,90 |
OK |
|
Baso |
0,80 |
14,21 |
0,91 |
0,00 - 1,80 |
OK |
|
Retic |
2,1 |
-3,50 |
2,0 |
1,60 - 2,40 |
OK |
|
Ret-He |
32,75 |
7,26 |
35,13 |
30,69 - 37,51 |
OK |
|
Tabell 9: Beregnet verdi på SLP nr. 3 i 2018 om den var analysert på XN-1000 med Sysmex kalibrator
|
|||||
|
Levanger |
4/2018 |
Metodeforskjell (%) |
Beregnet verdi |
Akseptabelt område |
Vurdering |
|
LPK |
3,50 |
0,64 |
3,52 |
3,24 - 3,96 |
OK |
|
EPK |
3,615 |
0,11 |
3,619 |
3,501 - 3,869 |
OK |
|
Hb |
12,25 |
-1,91 |
12,02 |
11,40 - 12,60 |
OK |
|
EVF |
0,36 |
-1,57 |
0,35 |
0,324 - 0,396 |
OK |
|
MCV |
100,0 |
-1,36 |
98,6 |
88,52 - 108,19 |
OK |
|
MCH |
33,9 |
-2,09 |
33,2 |
29,25 - 35,75 |
OK |
|
MCHC |
33,9 |
-0,51 |
33,7 |
29,97 - 36,63 |
OK |
|
TPK |
192 |
-0,75 |
191 |
166,8 - 250,2 |
OK |
|
Nøyt |
39,20 |
0,50 |
39,39 |
32,51 - 43,99 |
OK |
|
Lymf |
48,90 |
-1,57 |
48,13 |
41,57 - 56,24 |
OK |
|
Mono |
8,55 |
3,82 |
8,88 |
6,55 - 12,16 |
OK |
|
Eos |
2,45 |
-3,00 |
2,38 |
1,34 - 4,02 |
OK |
|
Baso |
0,90 |
14,21 |
1,03 |
0,00 - 2,55 |
OK |
|
Retic |
0,9 |
-3,50 |
0,9 |
0,68 - 1,02 |
OK |
|
Ret-He |
35,10 |
7,26 |
37,65 |
32 ,34 - 39,52 |
OK |
|
Tabell 10: Beregnet verdi på SLP nr. 4 i 2018 om den var analysert på XN-1000 med Sysmex kalibrator
|
|||||
|
Namsos |
2/2018 |
Metodeforskjell (%) |
Beregnet verdi |
Akseptabelt område |
Vurdering |
|
LPK |
4,8 |
0,85 |
4,84 |
4,14 - 5,06 |
OK |
|
EPK |
3,82 |
2,22 |
3,905 |
3,653 - 4,037 |
OK |
|
Hb |
12,1 |
-2,18 |
11,84 |
11,31 - 12,5 |
OK |
|
EVF |
0,37 |
-1,76 |
0,36 |
0,324 - 0,396 |
OK |
|
MCV |
96,35 |
-1,56 |
94,8 |
84,65 - 103,46 |
OK |
|
MCH |
31,65 |
-2,02 |
31,0 |
27,86 - 34,05 |
OK |
|
MCHC |
32,9 |
-0,19 |
32,8 |
29,57 - 36,14 |
OK |
|
TPK |
175 |
-1,22 |
173 |
139,2 - 208,8 |
OK |
|
Nøyt |
65,65 |
0,50 |
65,98 |
55,72 - 75,38 |
OK |
|
Lymf |
25,45 |
-1,57 |
25,05 |
21,42 - 28,98 |
OK |
|
Mono |
7,1 |
3,82 |
7,37 |
5,11 - 9,49 |
OK |
|
Eos |
1,30 |
-3,00 |
1,26 |
0,7 - 2,10 |
OK |
|
Baso |
0,50 |
7,97 |
0,54 |
0,00 - 1,05 |
OK |
|
Retic |
0,7 |
-1,64 |
0,7 |
0,56 - 0,84 |
OK |
|
Ret-He |
36,15 |
7,26 |
38,77 |
31,91 - 39 |
OK |
|
Tabell 11: Beregnet verdi på SLP nr. 2 i 2018 om den var analysert på XN-1000 med Sysmex kalibrator
|
|||||
|
Namsos |
4/2018 |
Metodeforskjell (%) |
Beregnet verdi |
Akseptabelt område |
Vurdering |
|
LPK |
3,70 |
0,85 |
3,73 |
3,24 - 3,96 |
OK |
|
EPK |
3,755 |
2,22 |
3,839 |
3,501 - 3,869 |
OK |
|
Hb |
12,3 |
-2,18 |
12,03 |
11,40 - 12,60 |
OK |
|
EVF |
0,37 |
-1,76 |
0,36 |
0,324 - 0,396 |
OK |
|
MCV |
98,4 |
-1,56 |
96,9 |
88,52 - 108,19 |
OK |
|
MCH |
32,75 |
-2,02 |
32,1 |
29,25 - 35,75 |
OK |
|
MCHC |
33,3 |
-0,19 |
33,2 |
29,97 - 36,63 |
OK |
|
TPK |
199 |
-1,22 |
197 |
166,8 - 250,2 |
OK |
|
Nøyt |
38,25 |
0,50 |
38,44 |
32,51 - 43,99 |
OK |
|
Lymf |
49,05 |
-1,57 |
48,28 |
41,57 - 56,24 |
OK |
|
Mono |
9,05 |
3,82 |
9,40 |
6,55 - 12,16 |
OK |
|
Eos |
2,80 |
-3,00 |
2,72 |
1,34 - 4,02 |
OK |
|
Baso |
0,85 |
7,97 |
0,92 |
0,00 - 2,55 |
OK |
|
Retic |
0,9 |
-1,64 |
0,9 |
0,68 - 1,02 |
OK |
|
Ret-He |
36,65 |
7,26 |
39,31 |
32 ,34 - 39,52 |
OK |
|
Tabell 12: Beregnet verdi på SLP nr. 4 i 2018 om den var analysert på XN-1000 med Sysmex kalibrator. |
|||||
Vi ser at resultatene ville blitt innenfor det akseptable området om instrumentet var kalibrert med Sysmex kalibrator. Dette vil bli kontrollert når vi mottar vår første SLP 20. Mars 2019.
SLP 1/2019 viser tilfredsstillende resultat, se SLP-rapporter. (11)
Samkjøring XN-1000 og XN-1500 etter kalibrering med Sysmex XN CAL og XN CAL PF
I tabell 13 presenteres resultatene av samkjøringen av XN-1000 og XN-1500 hvor 3 tilfeldig utvalgte pasientprøver uten morfologiske flagg ble analysert 10 ganger på hver av instrumentene. Dataene presentert her er fra Levanger.
|
Mean |
Mean |
Forskjell mean |
Snitt 1 STD |
Vurdering |
|
|
WBC |
6,03 |
6,06 |
0,03 |
0,085 |
OK |
|
RBC |
4,64 |
4,67 |
0,03 |
0,031 |
OK |
|
HGB |
14,95 |
14,96 |
0,01 |
0,065 |
OK |
|
MCV |
94,83 |
96,81 |
1,978 |
0,312 |
IKKE OK |
|
MCH |
31,24 |
31,36 |
0,12 |
0,212 |
OK |
|
PLT-I |
262,04 |
264,24 |
2,206 |
5,254 |
OK |
|
PLT-F |
167,28 |
164,82 |
2,456 |
2,389 |
IKKE OK |
|
NEUT |
61,65 |
62,2 |
0,547 |
0,572 |
OK |
|
LYMFO |
29,34 |
28,46 |
0,878 |
0,692 |
IKKE OK |
|
MONO |
9,59 |
9,76 |
0,164 |
0,452 |
OK |
|
EOS |
2,63 |
2,61 |
0,021 |
0,203 |
OK |
|
BASO |
0,68 |
0,6 |
0,076 |
0,153 |
OK |
|
RETIC |
0,09 |
0,09 |
0,001 |
0,003 |
OK |
|
RET-HE |
33,87 |
34,07 |
0,204 |
0,258 |
OK |
|
HYPO-HE |
0,18 |
0,14 |
0,031 |
0,03 |
IKKE OK |
Tabell 13: Samkjøring av XN1000 og XN1500 etter at begge er kalibrert med Sysmex XN CAL og XN CAL PF.
Som krav til samkjøringen ble det satt at forskjellen mellom instrumentene (forskjell mean) burde være < 1 analytisk standardavvik for hver parameter. Standardavviket brukt i vurderingen ble regnet ut som et snitt av standardavvikene til begge instrumentene.
MCV, lymfocytter, PLT-F og Hypo-He fikk større forskjell i mean enn 1 STD. MCV er som tidligere beskrevet en utregnet parameter følsom for endringer i HCT og EPK. På bakgrunn av at både HCT og EPK er OK, og at forskjellen på 1,978 fL er minimal og uten signifikant klinisk betydning, godkjennes forskjellen målt på MCV.
Det samme gjelder for lymfocytter og PLT-F. Forskjellene er små og uten klinisk betydning. Derfor godkjennes også disse parameterne til sitt bruksområde.
Forskjellen for Hypo-He er også minimal, men vil bli vurdert på nytt med prøver i et høyere nivå.
Vurdering av Hypo-He
Pga. at Hypo-He har kort holdbarhet (1, 8, 9), kan ikke riktighet og presisjon beregnes ut fra kontroller analysert over 20 dager. Pasientprøvene som er brukt i resten av valideringen er tilnærmet normale, og har derfor et meget lavt nivå av Hypo-He. Slike lave verdier er ikke så godt egnet til å vurdere analysekvaliteten, da det er høye verdier som er av klinisk betydning.
Det ble derfor analysert tre pasientprøver x 10, med forhøyet Hypo-He. Innen-serie-variasjon ble beregnet i tillegg til at meanverdiene mellom XN-1000 og XN-1500 ble sammenlignet.
|
|
Mean |
Mean |
Forskjell mean |
Snitt 1 STD |
CV |
Vurdering |
|
|
XN-1000 |
XN-1500 |
XN-1500 |
|||||
|
Hypo-He |
30,18 |
28,32 |
1,860 |
0,34 |
1,54 |
Vurdert OK |
|
|
|
|||||||
|
Tabell 14: Samkjøring av XN1000 og XN1500 etter at begge er kalibrert med Sysmex XN CAL og XN CAL PF |
|
||||||
Forskjellen i meanverdi mellom XN-1000 og XN-1500 er akseptabel og uten klinisk betydning. Presisjonen (innen-serie-variasjon) viser en CV på 1,5% i Hypo-He nivå ca 30%. Som vist i tabellene over, ble CV på 12% (Tabell 1-3) i et nivå på 0,2% Hypo-He, dette ut fra kontroller som ble analysert over 20 dager. Holdbarheten tatt i betraktning, og at resultatet kommer med bare én desimal, vurderes dette som ok.
Holdbarheten er i manualen beskrevet til å være 24 timer (følger holdbarheten til RBC-He). Vi har tidligere satt en holdbarhet på to timer. Dette ble etterprøvd med en enkel holdbarhetsstudie på 14 prøver (utført på Levanger), der tre var utenfor referanseområdet. Disse ble analysert hver time i 8 timer. Resultatet viste at det etter to timer ble signifikant forskjell. Derfor beholde holdbarheten på to timer. Tillatt Bias og totalfeil er satt av medisinsk faglig lege.(Vedlegg 11)
Ref område settes for voksne > 16 år, og kan benyttes da prøvene beskrevet i artikkelen(13) er analysert innen to timer:
Kvinner > 16 år: 0,1 – 1,1%
Menn > 16 år: 0,1 – 0,5%
Kontroll av blodprodukt
Analysering av erytrocyttkonsentrat, plasmakontroller og trombocyttkonsentrat ble grundig gjennomgått i valideringen av XN-1000 (4).
B-Hb og B-EVF analyseres som fullblod, B-TPK analyseres som fullblod og gis ut fra impedansekanalen. EPK og LPK i plasmakontroller analyseres i Body Fluid-kanalen og gis ut som væsker, TPK i plasmakontroller analyseres som fullblod med PLT-F.
Måleusikkerhet
Dette er omtalt i innledningen av rapporten.
Måleområde
Måleområde er listet opp i vedlegg 7 sammen med referanseområde og holdbarhet av prøvematerialet.
Morfologiske flagg
Henviser til Validering av XN-1000. (4)
Data/IKT
Det er over flere uker kontrollert at bestillinger hentes fra NSL og at svar fra Extended IPU overføres til ANP og videre til NSL som tiltenkt, dette er utført på Levanger.
Det er også i denne perioden sett at reglene som er lagt inn i EPU fungerer som tiltenkt (reanalysering pga meldinger/verdier, svar som må undersøkes videre holdes tilbake, blodutstryk blir laget). Alle regler som har vært mulig å framprovosere har blitt testet.
I en tid etter oppstart vil svarene godkjennes i EPU, overføres til ANP og bli sendt videre til NSL derfra. Etter hvert som både Levanger og Namsos ser at alt fungerer som tiltenkt vil alle svar bli autovalidert i ANP etter at de er validert i ANP.
Dokumentasjon av at dette fungerer, og når det ANP blir satt til å autovalidere alle svar som kommer fra EPU, blir skrevet i vedlegg i endringsmeldingen. Dermed blir ikke valideringen av EPU skrevet som et vedlegg til valideringsrapporten, slik det er beskrevet i valideringsplanen.
Regelsettet ligger som vedlegg til rapporten. (14) Reglene kan endres etter hvert som det ses hensiktsmessig.
KONKLUSJON OG GODKJENNING
XN-1500 godkjennes for analysering av alle parametere som er beskrevet i innledningen.
Pga. endring av kalibrator (CellDyn HemCal til Sysmex XN Cal), og at kravene til riktighet er innfridd, velger vi å benytte samme referansegrenser som de som er i bruk på SOH. (SOH har samme instrument, kalibrert med samme kalibrator) (5)
Komplett oversikt over referanseområder, holdbarhet og måleområder finnes i vedlegg 7. Alle er gjennomgått med medisinskfaglig ansvarlig og merket med referanser til hvor de er hentet fra.
Valideringsrapporten har vært til høring hos seksjonsledere og kvalitetsleder.
Instrumentet og nye referanseområder tas i bruk 15/5-19.
OPPFØLGING
I et samarbeidsmøte 6/5-19 (Levanger / Namsos) ble det gjennomgått hvilke punkter som må gjennomføres før, ved og etter oppstart. Listen legges som vedlegg til endringsmeldingen og brukes som dokumentasjon.
I tillegg vil kjøpsavtale, gjennomføringsplan fra Sysmex (SOW) og overleveringsdokument bli lagt som vedlegg i endringsmeldingen.
De fleste ansatte har vært gjennom opplæring, de som fortsatt mangler vil få opplæring før de kan ta i bruk instrumentet. Opplæring blir dokumentert i Kompetanseportalen.
Kvaliteten på analysene vil overvåkes ved hjelp av kommersielle kontroller, fullblods- og body-fluid-kontroller, og samkjøring av instrumentene. Rutiner angående analysering av kontroller vil komme frem av gjeldende versjon av arbeidsprosedyre for instrumentet (EQSdokument 5473).
I tillegg vil det følges program for ekstern kvalitetssikring / SLP.
Kontrollregler fastsettes ved hjelp av tillatt totalfeil. Disse er fastlagt etter en vurdering av analysens yteevne i forhold til de medisinsk behov, gjennomgått med Arne Åsberg 29/4-19, se vedlegg 8.
Kalibrering av instrumentet vil bli utført etter service, to ganger pr år, og ellers dersom det ses behov.
Svarrutiner for blodutstryk i NSL vil bli forandret. Analysen vil bli besvart med SeKom og status B (Besvart) når blodutstryk er laget og farget i SP-50.
Validering av DI-60 og DC-1 (Cellavision) kommer som en egen rapport.
10/5-19. Fagbioingeniører Ellen A Gylland og Åse Kristin Sandnes
Bioingeniør Guri Molden Kaldahl
Revidert:
25/6-19. Fagbioingeniør Ellen A Gylland
Tillegg til valideringsrapport
6/2-21 ble Beaker innført som nytt labdata-system, og ANP og NSL ble faset ut.
Resultatene går da ut til rekvirent via Beaker. Prøvesvarene blir fortsatt vurdert i EPU, og det som skal gå ut derfra skal være ferdig validert.
Autoverifiseringsreglene i Beaker har vært deaktivert siden oppstartsdato, og vi har sett at reglene fungerer som tiltenkt for både prøver og kontroller. Autoverifisering i Beaker ble aktivert for både Sykehuset Levanger og Sykehuset Namsos 24/2-21 (hematologi) og 5/3-21 (hematologi m/diff).
15/3-21. Fagbioingeniører Ellen A Gylland og Tone H Jonassen
Referanser:
- Manual Sysmex XN-1500, aug-17, ver. 22 og senere.
- Pakningsvedlegg, se www.Sysmex.no
- CG Fraser General strategies to set quality specifications for reliability performance characteristics Scand J Clin Lab Invest 1999; 59: 487 – 49
- EQS dokument 20865; Validering av Sysmex XN-1000
- Laboratoriehåndboka St.Olavs Hospital: http://data.stolav.no/labhandboker/Medisinsk_biokjemi/ask/TestFinder.html
- Kvalitetshåndboka til Avdeling for Laboratoriemedisin, HNT:
https://eqshnt.helse-midt.no/cgi-bin/document.pl?pid=hnt&DocumentID=5757&UnitID=1279 - Biologisk variasjon, database:
https://www.westgard.com/biodatabase1.htm - K. Chalvatzi, S. Spiroglou, A. Nikolaidou, E. Diza; Evaluation of fragmented red cell (FRC) counting using Sysmex - XE-5000 – Does hypochromia play a role?
- Ana Beatriz Barbosa Torino, Maria de Fátima Pererira Gilberti, Edvilson da Costa, Gisélia Aparecida Freire de Lima, Helena Zerlotti Wolf Grotto; Evaluation of red cell and reticulocyte parameters as indicative of iron deficiency in patients with anemia of chronic disease.
- RIAm: Regional IFU Amendment – Sysmex XN series Versjon 2.2 [13.okt.2017]
- Vurderingsrapporter SLP 1/2019 (EQSdok 29579 og 29575)
- Holdbarhet for analysene – EQSdok 26842 v 3.0, SOH
- J. M. Pekelharing, O. Hauss, R. de Jonge, J. Lokhoff, J. Sodikromo, M. Spaans, R. Brouwer, S. de Lathouder, R. Hinzmann; Haematology Reference Intervals for Established and Novel Parameters in Healthy Adults (Sysmex Journal International Vol. 20 No. 1 2010)
- Regelsett i EPU, EQSdok 29617