Arbeidsbeskrivelse
Transportbeholdere:
Det finnes flere typer beholdere for å transportere prøvematerialer slik at bakteriene holdes levende, samtidig som de ikke formerer seg av noen betydning. Dersom prøven ankommer i beholder uten tilsetning, bør prøven såes ut så snart som mulig. Det gjøres for at kvaliteten på prøvematerialet ikke skal forringes ytterligere.
Se: ALM-MM-Mottak; Prøvetakingsveileder
Tabell 1.0 viser eksempel på ulike typer transportbeholdere.
|
Prøvebeholder |
Bruksområde |
|
Sterile prøveglass |
Benyttes til sterile prøvematerialer (eks spinalvæske, leddvæske), aspirerte prøvematerialer (eks abscesser, leddvæske), ekspektorat, trakealaspirat. |
|
Sprøyter |
Benyttes til sterile prøvematerialer (eks spinalvæske, leddvæske) og aspirerte prøvematerialer (eks abscesser, leddvæske) |
|
eSwab (kommersielt medium) |
Er et væskebasert medium, hvor væsken i røret trekker prøvematerialet ut av prøve-pinnen. Benyttes til bla sår, nese, hals, øre, urogenitale prøver. |
|
Stuarts medium
|
Små flasker/glass med gel som selve prøvematerialet lagres i (eks vevsprøver, benbiter, aspirerte prøvematerialer). |
Dyrkingsmedier og reagenser:
Det benyttes en rekke dyrkingsmedier, både faste og flytende, avhengig av prøvemateriale og undersøkelse.
Tabell 1.1 viser eksempel på noen typer reagenser:
|
Reagens |
Bruksområde |
|
Sputolysin |
Er et enzym som tilsettes ekspektorat og trakealaspirat for at slimet skal løses opp. Kan også tilsettes seige bronkialskyllevæsker |
|
Glukosebuljong |
Benyttes til prøvematerialer (f.eks. kateterspisser, ben til/fra benbank) som skal subkultiveres. Benyttes også ved homogenisering av vevsprøver og lignende. |
|
GBS-buljong |
Selektiv for dyrkning av Streptococcus agalactiae spesielt mtp gravid screening |
|
Selenittbuljong |
Selektiv i påvisning av Salmonella spp og Yersinia spp. |
|
Ana-buljong |
Buljong som benyttes spesielt for å gi anaerobe bakterier optimale forhold. Buljongen er ikke selektiv. |
For oversikt over reagenser levert fra SOH se: ALM-MM-Mottak; Holdbarhet for medier fra SOH.
For andre leverandører se: ALM-MM-Mottak; Holdbarhet, bestilling og oppbevaring av medier
Alle medier og reagenser oppbevares ved 4 °C på kjølerom B0 24.
Diagnostiske lapper:
For å enklere kunne differensiere enkelte bakterier, benyttes diagnostiske lapper.
Tabell 1.2 viser oversikt over diagnostiske lapper:
|
Diagnostisk lapp |
Bruksområde |
Eksempel |
|
Metronidazole |
Benyttes på anaerobe prøver. Plasseres på FAA 1. strøk, i overgangen til 2. strøk se også fig 1. |
|
|
Gentamycin |
Benyttes på anaerobe prøver. Plasseres på FAA 1. strøk, i overgangen til 3. strøk se fi 1 |
|
|
Optochin |
Benyttes på prøver fra øre, øye og luftveier. Plasseres på GV-agar i overgangen mellom 1. og 2. strøk |
|
|
Novobiochin |
Benyttes i rutine som diagnostisk lapp for S. sapprophyticus. |
Legges på res.oppsett |
Valg av medier:
Skåler velges etter hvilket prøvemateriale som skal såes ut. Se ALM-MM-Mottak; Valg av medier ved utsåing av bakteriologiske prøver
Etter innregistrering av prøver merkes prøvene og skåler som skal benyttes ved utsåing.
Ved bruk av WASP til utsåing blir prøvene merket automatisk.
Undersøk alle skåler og medier med tanke på holdbarhetsdato og kontaminering ev frostskader. Frostskader vil observeres som marmorisert overflate, og skal da IKKE benyttes.
For utsæd av screening av ESBL/VRE se respektive prosedyrer:
ALM-MM-Fæces; Vancomycin Resistente Enterokokker (VRE) screening
Prøvene som såes ut manuelt:
Start med minst selektivt medium.
Eksempel:
1. Halsprøver:
Såes først ut på blodskål, deretter sjokoladeskål og til slutt på gv-skål.
2. Prøve fra operasjonssår (1 pinne):
Såes først ut aerobt på blod og sjokoladeskål, deretter på anaerobskål.
Generell utsåingsteknikk:
Beskrivelse av utsåingsteknikker som blir benyttet ved primærutsåing av prøver og ved sekundærspredning av bakterier/isolat, er mtp at det er ønskelig å oppnå enkeltkolonier. Ved vekst av flere typer bakterier skal disse kunne skilles fra hverandre.
Eksempler:
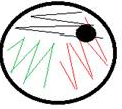
• Prøvepinner strykes utover 1/3 del av skåla. (Se figur 1.) Prøvepenselen roteres mens den strykes ut. Eller avsett en dråpe i 1. kvadrant.
• Øvre luftveisprøver og noen anaerobe prøver skal lappes med diagnostisk tablett. Diagnostisk tablett skal da legges i 1. kvadrant.
• Ved utsåing av prøver hvor det skal være både dyrkning (på skåler) og buljong, blir prøven først utsådd på skåler og deretter blir prøven tilsatt buljong; ved utsæd av flytende materiale avsettes ca 0,5 ml av materiale forsiktig nederst i buljongen, unngå bobledannelse. Ved vevsbiter avsettes den etter utsæd direkte i buljongen. Se ALM-MM-Mottak; Valg av medier ved utsåing av bakteriologiske prøver
Flytende væsker unntatt urin:
For utsæd av spinalvæske se: ALM-MM-Spinalvæske; Utsåing av spinalvæske og rutiner i forbindelse med funn.
Ved leddvæske og andre prøvematerialer i flytende form (unntatt urin), brukes steril pipette.
Prøvematerialet (1 dråpe) avsettes øverst på skåla og spres utover på ca 1/3 del av skåla (se figur 1).
Spre videre som vist i figur 1.
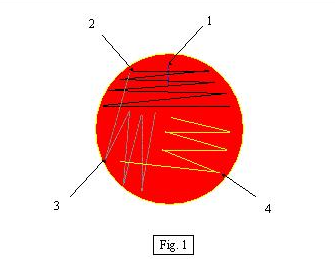
1.Prøvemateriale avsettes evt strykes utover 1/3 del av
skåla (ved prøvepinner)
2.Spredning i 1. kvadrant
3.Spredning i 2. kvadrant
4.Spredning i 3. kvadrant
Ved bruk av WASP til utsåing av flytende medier blir spredningen nært opp til spredning i figur 2.
Utsåingsmønster WASP:
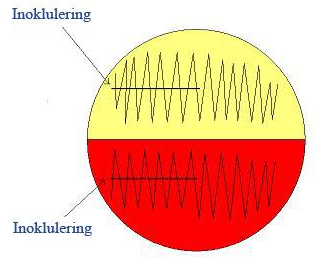
Figur 2.0 for Urinprøver.
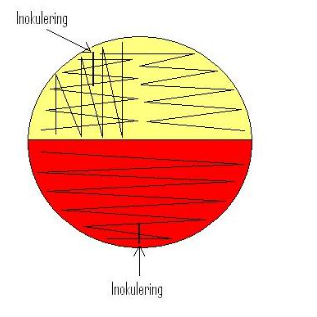
Manuelt utsæd av urinprøver:
Urinprøver såes ut med blank øse (1μl).
Urinprøven vendes et par ganger, øsen dyppes i urinen. Start inokulasjon med chrom - agaren, dypp deretter øsen på nytt i urinen og inokuler deretter CNA-agar. Se figur 3.0
Figur 3.0
Unntak: Prøver tatt ved suprapubisk blærepunksjon/blærepunksjon/urin tatt operativt gjennom urinlederne/cystoskopi-skal i tillegg såes ut på ulike medier.se ALM-MM-Mottak; Valg av medier ved utsåing av bakteriologiske prøver.
Candida-ChromID:
Såes ut som vist figur 1.
CNA - agar:
Såes ut som vist figur 1.
Sekundærspredninger:
Ved sekundærspredning av bakterier (for å få enkeltkolonier) er det viktig at spredningen ikke blir for tykk. Det kan benyttes enten klar øse (1 μl) eller blå øse (10μl). Plukk en koloni (eller deler av koloni alt etter størrelse) av bakterien som skal spres, og spre utover ca 1/3 del av ønsket skål.
Snu skåla en kvart omdreining. Dra øsa gjennom kanten av 1. kvadrant 1 gang og vend deretter øsa. Ta eventuelt ei ny øse. Spre utover i 2. kvadrant.
Snu skåla på ny en kvart omdreining. Spre utover i 3 kvadrant uten å komme bort i 1. eller 2. kvadrant.
Utsåing av fæcesprøver bør også gjøres som beskrevet i figur 2 da det er lett å få for tykke spredninger.
Oppformering av bakterier:
Ved dårlig vekst tas renkultur av den aktuelle bakterien og spres på ønsket skål. Det tas da så mye som mulig av bakterien som ønskes oppformert og spres utover skåla som under figur 1. I stedet for å spre bare en gang fra kvadrant 1 og 2 kan det med fordel dras flere ganger i disse strøkene. I enkelte tilfeller kan det også være nødvendig å oppformere bakterien i glukosebuljong som igjen sås ut på skåler.
Ved vekst av flere typer bakterier, og det er ønskelig å skille disse, spres disse til nye skåler.
Dersom det er for små mengder av bakterier som det skal gjøres videre arbeid med, må disse spres på ny(e) skål(er). En bør bestrebe seg å benytte et så lite selektiv medium som mulig. Utsæd gjøres som beskrevet i figur 1.