Hensikt
Sikre en hurtig og korrekt utsåing av blodkultur og videre arbeid med isolatet for identifisering og følsomhetstesting.
Omfang
Alle bioingeniører som er opplært til å utføre denne type analysearbeid ved ALM.
Grunnlagsinformasjon
ANALYSEPRINSIPP OG TERMINOLOGI
Generell bakteriologisk dyrkning (aerobe og anaerobe bakterier, samt gjærsopp).
MEDISINSK INDIKASJON
Kriteriene for anleggelse av blodkultur for den aktuelle pasient, bestemmes av klinikeren (rekvirent).
REFERANSER
Hovedreferanse:
1. Blodkultur, Rapport fra Strategimøte nr.33, 2019, Fostervold Mina Øydis Høie Christoffer Lindemann Einar Nilsen
2. Sopp, Rapport fra strategimøte nr 27, 2013, Cecilie Torp Andersen, Peter Gaustad og Kjersti Wik Larsen
EKSTERN KVALITETSKONTROLL
· Laboratoriet er med i SLP/ringtestene fra Folkehelseinstituttet hvor blodkultur isolat inngår i analyseprogrammet.
· NEQAS AST General bacteriology & Antimicrobial susceptibility
· LabQuality gram stain
INTERN KVALITETSKONTROLL
Arbeidsbeskrivelse
ANSVAR
Fagbioingeniør, som er tillagt denne analysegruppen, har ansvar for oppdatering av denne prosedyren.
HMS/sikkerhetsinformasjon
Alt direkte arbeid med blodkultur gjøres i sikkerhetsskap med hansker og gul smittefrakk.
Jfr. strategirapport 2019 om diagnostikk av blodkulturer skal tiltak for biotrygghet («Biosafety») sikre at arbeid med mikroorganismer foregår på en måte som ikke medfører helserisiko for ansatte. Se også spesielle hensyn under avsnittet Identifisering.
Avfallshåndtering
Positive blodkulturflasker med funn kan kastes når dyrkningsresultat er verifisert.
Negative blodkulturflasker kastes når de flagger ut negative i BACTEC FX
ARBEIDETS GANG
Usikkerhetsbidrag, feilkilder og interferens
Feil fortolkning av funnet pga. kontaminering med mikrober under prøvetaking
For lite blod i blodkulturflaska.
For mye blod i blodkulturflaska.
For kort inkubasjonstid for spesielle typer mikrober.
Aktuelle mikrobe vokser ikke på standard mediene.
Pasienten har høyt antall med leukocytter.
Fremgangsmåte/Utførelse av analysen
Protokolltid blodkultur
Alle blodkulturflasketyper står til inkubering i 7 dager.
Unntak: Dersom spesifikk mistanke om Nocardia species på flasker som allerede er satt til inkubasjon økes protokolltid til 21 dager. Flaskene bør i slike tilfeller gulmerkes med følgende beskjed: NB! Dersom flaske blir positiv etter dag 7 skal den sendes SOH for utsæd.
TTD
Ved ønske om tidsvindu for positive blodkulturer kan vi gå inn på TTD (time to detection) på Epicenter. Gå inn i bildet Specimen Registration. Under Accession, scan flaskens Beaker nr Trykk tab. Under test finner du TTD.
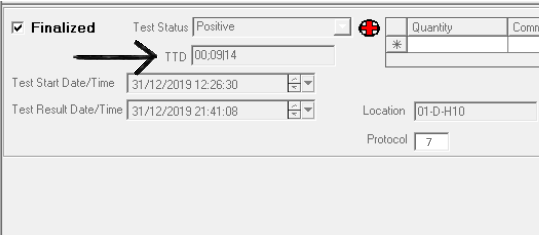
I eksempelet på bildet er TTD 9 timer og 14 minutter.
TTD legges inn som kommentar i Beaker.
Blodkulturer utsådd på vakt av medisinsk biokjemi Levanger (MB).
Vaktpersonell ved Medisinsk biokjemi Levanger sår ut etter ALM-MM-Mottak; Utsåing av positive blodkulturer, arbeidsbeskrivelse for vaktpersonalet ved medisinsk biokjemi.
Resistensmekanismer på Filmarray
Sjekk funn på FilmArray på blodkulturflasken(e) fra Namsos.
Dersom det er flagget resistensmekanisme (MRSA) på S.aureus legges følgende kommentar til funn: «Mulig MRSA. Se svar på filmarray. Verifisering av funn og følsomhetsbestemmelse ventes ferdig i morgen. Smitteregime anbefales.»
Dersom det er flagget resistensmekanisme på påvist isolat, legges følgende kommentar til grampreparatfunn: «Mulig XXX. Se svar på filmarray. Verifisering av funn og følsomhetsbestemmelse ventes ferdig i morgen. Smitteregime anbefales.». Erstatt XXX med resistensmekanisme.
Bruk skjønn da resistensmekanisme kan gi utslag på bakterier som er naturlig resistent. F.eks. Pseudomonas aeruginosa. I slike tilfeller må man vurdere å fjerne automatisk kommentar fra filmarraysvaret som omhandler påvist resistensmekanisme.
Hvis resultatet på filmarray er verifisert overføres analysen hit slik at vi får trigget overføring.
For å få overført verifiserte analyser fra Namsos til Levanger må disse først prøvekorrigeres i Namsos sitt system. Dette gjøres i feltet «Endre kontekst». Husk å endre tilbake til Levanger for videre arbeid med analysen.
Telefonisk varsling
Velg Komm.logg for å notere tlf.beskjed til avd./rekvirent
Telefonisk varsling utføres når det er ny informasjon som er av interesse for kliniker, og vil være aktuelt ved oppdatert informasjon knyttet til identifikasjon og følsomhetsbestemmelse. Det er ikke nødvendig å informere per telefon dersom pasienten er død.
Pasienter tilknyttet Levanger
Informasjon gis i utgangspunktet til ansvarlig sykepleier. Alternativt kan postsekretær ta imot beskjed. Skriv navn og avdeling på kommunikasjonslogg.
Rutine på lørdag/søndag/helligdag:
For medisinsk avd.: Beskjed om positiv blodkultur gis til vakthavende lege tlf. 8712
Hvis mikrobiologisk lab. mottar beskjed om at pasienten er reist hjem, skal mikrobiologisk lab. varsle funnet til vakthavende lege.
For øvrige avd. inkludert kirurgiske poster: Beskjed om positiv blodkultur til sykepleier som har pasienten ved sengeposten. Ved noen avd. tar postsekretær imot prøvesvar.
En sykepleier kan ta imot beskjeden og varsler videre visittgående lege samme dag eller påfølgende dag dersom det skjer utenom vanlig arbeidstid.
Samme rutine gjelder ved varsling av positive blodkulturer hos pasienter som har reist fra sykehuset.
Pasienter tilknyttet Namsos
Informasjon gis i utgangspunktet til ansvarlig sykepleier. Alternativt kan postsekretær ta imot beskjed. Skriv navn og avdeling på kommunikasjonslogg.
Dette gjelder både hverdager og lørdag/søndag/helligdager.
Følg samme rutine dersom laboratoriet får melding om at pasienten er reist hjem.
Utflagging av positiv blodkulturflaske og negativ mikroskopi
Hvis det ikke påvises bakterier ved mikroskopi kontrolleres flaskens vekstkurve ved å gå inn i Epicenter. Se under relatert for eksempel av vekstkurver.
A. Ved positiv vekstkurve/plot:
Utfør agglutinasjonstest for pneumokokker direkte fra
blodkultur. Dersom denne testen er klar positiv og ingen vekst i subkultur,
besvares undersøkelsen med:
SVARKODE: IV (Ingen vekst)
KOM: PNE3 (”Død mikrobe. Supplerende analyser forenelig med Strept. pneumoniae.”)
Blodkulturflasken sendes til pneumolysin-PCR (SPNP)
B. Ved negativ vekstkurve/plot:
Flasken settes tilbake i blodkulturmaskinen.
OBS! Flasken bør settes inn igjen innen 5 timer etter at den er tatt ut, for å fortsette i samme inkubasjons-syklus. Dersom det er gått over 5 timer utføres ny 7-dagers inkubasjon.
Disse blodkulturflaskene oppfattes som sannsynlig «falsk positive» og ingen svar sendes til rekvirenten inntil endelig negativ dyrknings resultat kommer. Ved ingen vekst kastes skålene etter dag 5, og undersøkelsen besvares «Ingen vekst» når ny inkubasjon er fullført.
Reinkubering av falsk positive blodkulturer: Stå med markøren på den aktuelle inkubasjonsanalysen (blodkultur aerob/-anaerob), og velg «GJENTA TEST». Blodkulturen kan da settes tilbake i BACTEC FX.
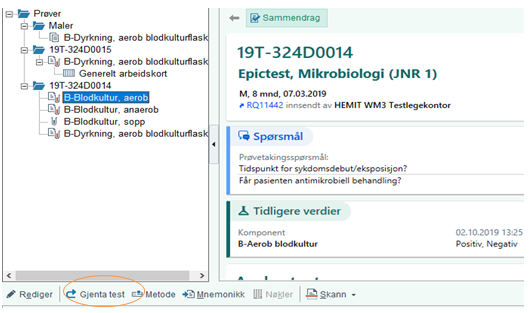
Dersom inkubasjonsanalysen på Namsos er verifisert: For å få overført verifiserte analyser fra Namsos til Levanger må disse først prøvekorrigeres i Namsos sitt system. Dette gjøres i feltet «Endre kontekst». Husk å endre tilbake til Levanger for videre arbeid med analysen.
Dag 0
For hvert pasienttilfelle skal det være med MacConkeyagar for å vurdere laktosespalting hos E.coli. Se eget avsnitt i prosedyre ALM-MM-Bakt; MaldiTof Sirius, bruk og vedlikehold. Dette er kun nødvendig på 1. flaske som kommer ut positiv. I tillegg tas det med ett saltvannsglass for en av flaskene merket med valgfri esktra etikett. Her tilsettes 4 dråper fra blodkulturflasken til direkte følsomhetstesting.
Direktepreparat (våtpreparat) lages ved behov. Vurderes av den enkelte bioingeniør og dokumenteres i lab. kommentarfeltet.
· Utsæd
Scan flaske i oppsettsbenk.
For aerob flaske velg sjokoladeagar, blodagar, deltskål og eventuelt McConkeyagar + preparat.
For anaerob flaske velg sjokoladeagar, blodagar, deltskål, FAA og eventuelt McConkeyagar + preparat.
For soppflaske velg sjokoladeagar, blodagar, deltskål og eventuelt McConkeyagar + preparat. Ta i tillegg med sabouraudagar (29 ºC og 35 ºC), samt kromogen gjærsoppagar (29 ºC).
For flasker som er utsådd på vakt ved Levanger:
Legg til allerede dyrkede skåler i oppsettsbenk med riktig utsåingstidspunkt.
Lag grampreparat av den/de positive blodkulturflaskene som er utsådd på vakt. Så også ut FAA-agar dersom anaerob blodkulturflaske.
For flasker som kommer med transportkasse fra Namsos: Scannes i mottak. Sjekk om det foreligger svar på filmarray og se etter eventuelle resistensmekanismer.
Se eget avsnitt «Resistensmekanismer på filmarray». Er det påvist Cryptococcus neoformans/gatti med FilmArray skal ikke videre arbeid med blodkulturen(e) utføres på Levanger. Denne mikroben krever innslutningsnivå 3 for behandling og blodkulturflasken(e) skal sendes SOH.
Ved uttak av skåletiketter: påfør en strekkodeetikett med Levanger-nummer på korresponderende flaske med N-nummer slik at man har sporing ved utsæd.
· Grampreparat
Utføres på alle positive blodkulturflasker. Dersom ingen funn i grampreparat, se avsnitt «Utflagging av positiv blodkulturflaske og negativ mikroskopi»
Ved funn som tyder på oppvekst av sopp, eller positiv soppflaske, ta med sabouraudagar (29 ºC og 35 ºC), samt kromogen gjærsoppagar (29 ºC).
· Sepsityper
Ved nytt tilfelle (ny pasient) på dagtid utføres Sepsityper på Malditof på 1 flaske. Sjekk grampreparat før oppsett. Se ALM-MM-Bakt; MaldiTof Sirius, bruk og vedlikehold for fremgangsmåte. Identifikasjon rapporteres samtidig med preparatfunn som foreløpig svar. Se eget avsnitt «telefonisk varsling».
OBS! Forbehold:
Ved funn av store grampositive staver mikroskopisk hvor det mistenkes Bacillus utføres IKKE sepsityper. Se prosedyre ALM-MM-Id; Identifisering av Bacillus spp.
Ved funn av veldig små gramnegative
staver mikroskopisk, kan dette indikere en mulig Francisella- eller Brucella-infeksjon
hos pasienten spesielt om klinikk oppgir reiseanamnese. Følgende morfologi
gjelder Burkholderia pseudomallei: Gram negativ stavbakterie, rett eller
lett buet. Kan farge bipolart (”sikkerhetsnål”). Preparat tatt fra eldre
kulturer kan farge mer perifert (som endosporer).
Hvis blodkulturflasken i tillegg har stått inkubert i BACTEC i 5-6 dager, vil
dette forsterke mistanken om mulig oppvekst av eksempelvis Francisella.
Direkte MALDI-TOF kan utføres, da matrix inaktiverer disse mikrobene. Dersom
man får treff på disse mikrobene utføres IKKE videre arbeid. Disse
bakterieartene klassifiseres i smitterisikogruppe 3 og krever innslutningsnivå
3 for videre arbeid. Ved funn i kliniske prøver sendes prøvemateriale eller
kultur til Beredskapslaboratoriet ved FHI for videre undersøkelse. Se
ALM-MM-Bakt; Varsling, frysing og videresending av bakterieisolat.. Medisinsk faglig rådgiver varsles for å gi
tilbakemelding til rekvirent ev. råd mtp. antibiotikabehandling. Utenom vanlig
ukedag og medisinsk faglig rådgiver ikke er tilstede skal rekvirenten varsles
av bioingeniør.
· Direkte følsomhetsbestemmelse
Ved identifikasjon med sepsityper kan de fleste respektive oppsett følges.
I tilfeller hvor man ikke får god ID på sepsityper:
For gramnegative staver benyttes 3 MH-agar med stemplene gram negativ stav 1 & 2 og Pseudomonas 1.
For grampositive kokker i hauger benyttes 2 MH-agar med stemplene Staph 1 & 2.
For grampositive kokker i kjeder benyttes 2 MH-βnad og 1 MH-agar og lappes for å dekke opp streptokokker, pneumokokker og enterokokker (stempel på MH).
· Inkubasjon
Aerobskåler inkuberes ved 35° +/- 2ºC i CO2-inkubator i 2 døgn ved oppvekst aerobt eller anaerobt og inntil 5 døgn dersom ikke oppvekst (ved mistanke om kravstore mikrober kan avlesning i opptil 5 dager være indisert før man konkluderer med at mikroben ikke vokser).
Anaerobskåler inkuberes anaerobt i 2 dager dersom aerob vekst, og inntil 5 døgn dersom ingen oppvekst.
Selektive soppskåler inkuberes aerobt i totalt 3 dager. Skålene inspiseres daglig. Sabouraudagar ved 29 ºC og 35 ºC, kromogen gjærsoppagar ved 29 ºC.
·
Rutiner ved
funn av soppisolat
Vanlig rutine: videresendes til SOH for følsomhetstesting samme dag ev. påfølgende
dag. Vurder å send flaske dersom den kommer med før 12. Ellers sendes
sabouradagar med best vekst.
Ved helg/helligdager: Ta kontakt med vakthavende lege på medisin eller kirurgi
og spør om følsomhetsbestemmelse haster så mye at den skal sendes med drosje.
Dersom det er ønskelig fra avdeling må det videre avklares med SOH per telefon.
Konferer vakthavende mikrobiolog. NB! Gi beskjed til SOH at vi videresender
funnet til referanselaboratoriet. Hvis flasken sås ut søndag og helligdager med
påfølgende normal arbeidsdag er det ikke nødvendig å sende flasken. Da venter
vi til neste dag og sender skål med vekst.
Isolat sendes referanselaboratoriet. Se ALM-MM-Bakt; Varsling, frysing og videresending av bakterieisolat.
Blodkulturer som er utsådd tidlig på dagen, inspiseres for vekst på slutten av dagen.
Ta om mulig Maldi-Tof av slørvekst dersom man ikke har fått god score med sepsityper.
Dag 1
· Identifikasjon fra vekst. Dersom det er utført sepsityper dagen før med konsistenskategori A er det ikke nødvendig å utføre ny malditof med mindre man mistenker annet funn. Ved diskrepans fra sepsityperresultat, ta kontakt med faggruppe 1. Isolat fra alle positive flasker hos samme pasient skal identifiseres med malditof.
Alle blodkulturisolat som tillegges klinisk betydning identifiseres ned til artsnivå i alle positive blodkulturflasker.
· Følsomhetsbestemmelse fra vekst. Husk eventuelt NORM-midler.
Proteseinfeksjoner og ostemyelitt med bakteriemi/sepsis. Ved positive blodkulturer med kliniske opplysninger som krever langtids behandling (f.eks. proteseinfeksjoner, osteoartikulære infeksjoner som ostemyelitt ol.), kan det være behov for MIC-bestemmelse. Konferer med medisinsk faglig rådgiver.
Ved manglende behandlingsrespons tross bruk av virksomt antibiotika kan følsomhetstesting fra mer enn en flaske være aktuelt.
Det anbefales ny ID (identifisering) og følsomhetstesting ved nye positive blodkulturer tatt med >24 timers intervall
· Frys isolatet. Alle positive funn (også kontaminanter) føres inn i frysliste på Teams Frysskjema BLODKULTUR_1_ (fra nr 71_17).xlsx. Skriv ut etikett og skriv på frysnummer samt mikrobefunn på etiketten og frys ned stammen. Alle isolatet fryses ned i -80°C. Et gitt isolat fryses ned en gang for hver episode.
· Telefonisk beskjed til rekvirent. Se eget avsnitt: «Telefonisk varsling».
· Noen funn er meldepliktige til MSIS. Se oversikt i ALM-MM-Bakt; Varsling, frysing og videresending av bakterieisolat.. Videresend til referanselaboratorium på hverdager. Unntak: forsendelser til K-res og FHI bør skje mandag til torsdag for å unngå lang transporttid.
Dag 2
· Sjekk at alt arbeid med prøven er gjennomført. Utfør eventuelt resterende arbeid. Endelig verifiser svar.
Unntak:
§ Gjentakende positive kontrollsett med S.aureus skal inkuberes opptil 7 dager for å oppdage småkolonivarianter. Se eget avsnitt.
§ Videresendte isolat som avventer svar fra referanselaboratorium eller samarbeidende laboratorium før endelig svarutgivelse. Se ALM-MM-Admin; Svarrapportering ved Lab. for medisinsk mikrobiologi.
§ Skåler uten vekst skal stå inntil 5 dager før besvarelse. Hvis ikke oppvekst (aerob og /eller anaerobt) tross «positiv» mikroskopi, ev. dårlig vekst på skålene, konferer med medisinsk faglig rådgiver, ev. fagbioingeniør (utenom vanlig ukedag kan mikrobiolog på samarbeidende laboratorium kontaktes)
Vurder om klinikk og gram-funn gir mistanke om saktevoksende mikrober/mikrober med spesielle vekstkrav?
vurder nytt utsæd ev. på spesialmedier ut i fra mistenkte mikrobe
vurder ytterligere flere dagers inkubasjonstid (>5)
· Sett en skål i vekksett, resten kastes.
· Ved ingen vekst på skåler: Hos barn < 5 år, og ved kliniske opplysninger om artritt, osteomyelitt eller lignende, hvor det er funn av gramnegative bakterier ved mikroskopi, men negativ oppvekst, sendes blodkulturen til St. Olavs for Kingella kingae PCR (konf. vakthavende lege ved SOH).
Spesielle hensyn knyttet til ulike funn
Salmonella spp, Shigella spp, Yersinia spp, Vibrio spp.
Isolat sendes SOH så hurtig som mulig for nærmere identifisering. Mikrobiolog på SOH kontaktes på helg og helligdager for å høre om prøve skal sendes med taxi.
Se ALM.MM-Fæces; Vurdering og besvaring av funn (Ikke tilgjengelig)
Campylobacter spp:
Ved mistanke om Campylobacter på bakgrunn av mikroskopi sås CCDA ut mikroaerofilt ved 35 og 42 grader. I tillegg sås ekstra blod og sjokolade ut mikroaerofilt ved 35 grader. Husk kontroller!
Se ALM.MM-Fæces; Vurdering og besvaring av funn (Ikke tilgjengelig)
Staphylococcus spp:
Ved oppvekst av S. aureus tas følgende kommentar med i svaret: .NYB (Ny kontroll av blodkulturer anbefales 48 timer etter oppstart av behandling.)
Småkolonivarianter:
Ved oppvekst av S.aureus / S.argenteus hos pasienter med mistanke om endokarditt, eller i kontrollprøver tatt 48-72 timer etter tidligere funn av S. aureus/S.argenteus, bør skålene inkuberes i inntil 7 dager.
Dette for å lete etter småkolonivariant (SCV) av S.aureus/ S.argenteus.
Vurderingen gjøres i de områdene på skålen med minst vekst av S.aureus/ S.argenteus og med normal kolonimorfologi. Gjentatte funn eller opplysninger om behandlingssvikt, ta kontakt med vakthavedne lege SOH for ev. vurdering av PCR med tanke på meticillinresistens.
Det er 2 hovedformål med dette:
1. Å oppdage disse variantene, spesielt ved mistanke om endokarditt, da disse som regel er langsomvoksende
2.
Å få utført
følsomhetstesting, da disse variantene er ofte assosiert med vedvarende og
tilbakevendende infeksjoner på grunn av deres evne til å overleve i fiendtlige
miljøer, som inne i vertsceller, samt de kan være ganske resistente.
Dersom det vokser gule stafylokokker med både normal morfologi og småkolonivarianter, skal det utføres følsomhetstest på begge. Dersom det er mistanke om terapisvikt til tross for tilstrekkelig antibiotikabehandling basert på følsomhetstesten, kan stammen(e) i tillegg sendes St. Olavs for mecA-PCR og evt. PCR for PVL-produserende gule stafylokokker.
Mistenkt Streptococcus pnuemoniae:
Pneumokokk-agglutinasjon direkte fra blodkultur.
Hvis positiv: Gi rekvirent beskjed: "Positiv i pneumokokkk-agglutinasjon, sannsynlig pneumokokk".
Det finnes risiko for kryssreaksjon mellom streptokokker.
Beta-hemolytiske streptokokker:
Artsnavn i mikrobefeltet. Lancefield-gruppe i kommentarfeltet. Se prosedyre ALM-MM; Resistenspanel for blodkultur og spinalvæske for kommentarer.
Vurdering av funn som kan være kontaminanter
Den viktigste feilkilde ved fortolkning av funn i blodkultur, er kontaminering av mikrober fra hudfloraen. De mikrobene som hyppigst kan være kontaminanter er koagulase negative stafylokokker (unntak: Staph. lugdunensis), difteroider -Corynebakterier spp. (unntak: Corynebacterium diphteria, C. ulcerans eller C. pseudotuberculosis), Bacillus spp. (unntak: Bacillus anthracis), Cutibacterium acnes (tidligere Propionebacterium acnes), og Micrococcus luteus.
KNS samt corynebakterier representerer vanligvis forurensing, men kan også gi septikemi. Generelt gjelder at jo flere positive blodkultursett, jo større er sannsynligheten for at funnet representerer en reel bakteriemi. Ved tilstander hvor potensielle kontaminanter er årsak til bakteriemi, vil man nesten alltid få oppvekst i flere sett.
Viridans streptokokker er veldig sjelden en forurensing pga. overføring i blodkulturflasken fra pasientens hudflora ved prøvetaking.
I en ganske stor andel representerer likevel viridans streptokokker en forbigående blodbaneinfeksjon som raskt går over av seg selv (f.eks. bakterier som overføres i blodet fra pasientens munnflora).
I noen tilfeller kan viridans streptokokker fra blodkultur tyde på en alvorlig infeksjon (eg. endokarditt). Ved besvaring av viridans streptokokker skal det ikke være med noen spesiell kommentar.
Cutibacterium acne (tidligere Propionebacterium) er oftest kontaminert fra hud. Bacillus arter er som oftest kontaminanter med unntak av Bacillus anthracis som alltid er patogen. B. anthracis mangler hemolyse på blodskål.
Bacillus spp.
NB! Ved
mistanke om Bacillus anthracis skal det IKKE utføres arbeid med stammen.
Stammen skal i slike tilfelle sendes FHI.
Se prosedyre ALM-MM-Id; Identifisering av Bacillus spp
Fra oppvekst:
Følsomhetsbestemmelse hvis oppvekst i 2 eller flere flasker. Dersom kun et blodkultursett
er tatt og/eller ved kliniske opplysninger om rusmisbruk utføres også følsomhetsbestemmelse
når oppvekst i kun en flaske.
Valg av
antibiotika se ALM-MM; Resistenspanel for blodkultur og spinalvæske
Bacillus
cereus gruppen
(untatt B.anthracis) forutsatt at penicillin er avlest som resistent,
besvares med kommentaren BAM ("Bacillus cereus produserer
bredspektret betalaktamase og er dermed resistent mot alle penicilliner og
cefalosporiner")
Vekst i kun
av 1 av 4 eller flere flasker tolkes som forurensing og besvares med
identifikasjon og sannsynlig forurensing (SAFO). Obs! unntak hvis kliniske
opplysninger om rusmisbruk (kjente utbrudd med Bacillus spp). Konferer
ansvarlig lege. FHI kontaktes ved mistanke om utbrudd.
Vekst i 1 av 2 blodkulturer vurderes som mulig forurensing, besvares med
identifikasjon og følsomhetsbestemmelse, Kommentar MF ("mulig
forurensing") og «Standard prøvetaking til blodkultur innebærer minst 2
blodkultursett fordelt over 24 timer! Ny prøve anbefales ved fortsatt mistanke
om infeksjon».
Koagulase negative stafylokokker (KNS) (Micrococcus luteus vurderes som KNS)
Ved koagulase negative stafylokokker skal det gjøres følsomhetstesting fra hver venepunksjon etter vurdering
Vekst av KNS i 1 av flere (4) blodkulturer vurderes ofte som forurensning (konf. lege).
Besvares uten følsomhetsbestemmelse med:
Kommentar: SAFO:
«sannsynlig forurensning»
Vekst i 1 av 2 blodkulturer vurderes som mulig forurensing, besvares med identifikasjon og resistens.
Kommentar: MF: «mulig forurensing»
Dersom dette ikke gjelder nytt frostanfall under samme episode (tidligere tatt blodkulturer under gjeldende sykehusinnleggelse)
Kommentar: S224: «Standard prøvetaking til blodkultur innebærer minst 2 blodkultursett fordelt over 24 timer! Ny prøve anbefales ved fortsatt mistanke om infeksjon».
Ved endokarditt skal kommentaren tas med uavhengig av om det er nytt frostanfall.
Kommentar: S224
Ved tvil konferer medisinsk faglig rådgiver.
Tilfeller av KNS som blir behandlet som reelle funn:
· Ved vekst av hvite stafylokokker fra pas. med CVK eller annet fremmedlegeme:
o 1 av 4 flasker: følsomhetsbestemmelse settes opp. Besvaring/rapportering vurderes av medisinsk faglig rådgiver. Eventuell besvaring: Dersom funn i blodkultur er tatt fra CVK, gi ut følsomhetsbestemmelse med kommentar: «Mistenkt kolonisering av kateter» dersom det er tatt blodkulturflasker både perifert og fra CVK. Dersom det kun er tatt fra én lokalisasjon kan følsomhetsbestemmelse gis ut med kommentar «Mulig kontaminasjon. Ved kateterrelatert blodstrømsinfeksjon anbefales det å ta blodkultur både perifert og fra CVK».
o 2 av 4 flasker: Gi ut med følsomhetsbestemmelse uten videre kommentar.
· Hos nyfødte/barn hvor vi mottar kun en blodkulturflaske, identifiseres funnet og besvares med følsomhetstest.
· Funn av S.lugdunensis tolkes som klinisk signifikant på lik linje som S.aureus selv om funn kun i 1 av 4 eller 1 av 2 flasker.
· Ved oppvekst av S.intermedius eller S.pseudointermedius (zoonotiske patogener) skal disse besvares med id og følsomhetstest uansett om det kun er 1 av 4 flasker som er positive.
· Ved funn av S.saccharolyticus , skal disse besvares med id og følsomhetstest uansett om det kun er 1 av 4 flasker som er positive. Følsomhetstest utføres anaerobt.
· Ved funn av S.capitis hos nyfødte, gi beskjed til medisinsk faglig rådgiver da den er kjent som årsak til infeksjonsutbrudd på flere nyfødt intensive avdelinger.
Corynebakterier
Vekst i 1 av
4 eller flere blodkulturflasker vurderes ofte som forurensning, og besvares som
DIST ("difteroide staver") med SAFO som kommentar. Identifikasjon
utføres selv om vi kan svare ut som DIST, men følsomhetsbestemmelse er ikke
nødvendig.
Vekst i 1 av 2 blodkulturer vurderes som mulig forurensing, besvares med
identifikasjon og resistens, Kommentar MF ("mulig forurensing") og S224
««Standard prøvetaking til blodkultur innebærer minst 2 blodkultursett fordelt
over 24 timer! Ny prøve anbefales ved fortsatt mistanke om infeksjon»).
Ved funn av Corynebacterium diphteria, C. ulcerans eller C.
pseudotuberculosis betraktes disse ikke som sannsynlig forurensing. Dette
kan være toksinproduserende stammer, og kan bla isoleres fra pasienter med
endokarditt. Ansvarlig lege varsles, som varsler rekvirent og kontakter FHI.
Det skal ikke utføres arbeid med stammen. Stammen skal i slike tilfelle sendes
FHI for toksinpåvisning. Se ALM-MM-Bakt; Varsling, frysing og videresending av bakterieisolat.
Valg av antibiotika se ALM-MM; Resistenspanel for blodkultur og spinalvæske