Hensikt
Sikre riktig bruk av Hema-Tek Slide Stainer til farging av blodutstryk og margutstryk.
Omfang
Prosedyren omfatter alle ansatte ved Avdeling for Laboratoriemedisin som er godkjent til bruk av Hematek Slide Stainer.
Se ALM-; Opplæring, oppdatering og vedlikehold/heving av kompetanse .
Grunnlagsinformasjon
HISTORIKK
Hematek Slide Stainer har vært i bruk siden slutten av 1970-tallet.
Nytt instrument av samme type tatt i bruk 2011 på Namsos og 2013 på Levanger.
I 2019 ble også Sysmex XN-1500, hematologiinstrument inkludert utstryks- og fargemaskin,
installert på begge sykehus.
ANALYSEPRINSIPP OG TERMINOLOGI
Hematek slide Stainer er en helautomatisk fargemaskin. Laboratoriet benytter modifisert Wright’s fargemetode til farging av blod- og beinmargsutstryk på Hematek. (XN-1500 har May Grünwald Giemsa-farging)
Ved farging med modifisert Wright’s fargemetode vil ulike blodceller få forskjellige farger. Metoden egner seg derfor godt til manuell differensialtelling.
Med Wright’s fargemetode benytter en 4 forskjellige fargeprinsipp for å identifisere de ulike celletypene. Basophilia (affinitet for methylene blå), azurophilia (affinitet for oksideringsproduktene av methylene blå kalt azures, som er rødlig fiolett), acidophilia (affinitet for eosin), og neutrophilia (affinitet for et kompleks av fargestoffene i blandingen, som er lyslilla).
I et farget blodutstryk binder erytrocytter eosin og blir farget orange til rosa, kjerner blir blå-lilla, basofile korn meget mørk blålig fiolett, eosinofile korn rød til rød-orange, neutrofile korn rødlig-brun til lyslilla, blodplater fiolett, og cytoplasma i lymfocytter farges svak blå.
REFERANSER
Hovedreferanse:
1) Operating Manual, Hematek® Slide Stainer, Siemens, 2008.
Tilleggsreferanser:
2) Technical Service Bulletin (Vedlikehold av Hema-Tek® Slide Stainer), Ames Company, utgivelsesdato ikke angitt.
3) Brukermanual, Hematek® Slide Stainer, Siemens (Utgivelsesdato ikke angitt)
4) Håndbok I mikroskopi, Morten Motzfeldt Laane og Thore Lie, Universitetsforlaget, sep. 1992.
5) Fremgangsmåte for HEMA-TEK slide stainer, Sentrallaboratoriet, Innherred sykehus, januar 1978.
Høring:
6) Prosedyren har vært til høring hos driftsleder, bioingeniører ved Medisinsk biokjemi Sykehuset Levanger.
Vedlegg:
Kvitteringsskjema for vedlikehold:
ALM-MB-Koag-L: Kvitteringsskjema. Daglig/Ukentlig. Kontroller, vedlikehold og reagens på koagulasjon, senkning og fargemaskin. og
ALM-MB-Hem; Kvitteringsskjema. Månedlig/Årlig/Ved behov. Vedlikehold på Sysmex og Hematek fargemaskin.
Arbeidsbeskrivelse
Kort oversikt
- Oppstart/Klargjøring av fargemaskin
- Farging av utstryk
- Daglig avslutting av fargemaskin
- Skifte av reagens
- Månedlig vedlikehold
- Annet vedlikehold
6.3. Justering av reagenspumpene
ANSVAR
Fagbioingeniør og/eller spesialbioingeniør har ansvar for prosedyren og oppdatering av denne. Alle som har godkjent opplæring i bruk av Hema-Tek Slide Stainer er selv ansvarlig for å gjøre seg kjent med og følge prosedyren. Se Omfang
HMS/sikkerhetsinformasjon
Ved vedlikehold av instrument bør en beskytte seg mot potensielt smittefarlige rester. Gode rutiner i forbindelse med prøvetaking er viktig for å unngå stikkskader. Ved uhell vises til nivå 1 prosedyre Stikkskader.Tiltak ved stikkskader og andre hendelser som kan medføre blodsmitte..
Alle blodprøver skal behandles som potensielt smittefarlig. Se prosedyre for Usterile engangshansker. Valg og bruk av usterile hansker og Håndhygiene.
HMS-datablad for reagensene finnes i Ecoonline:
ARBEIDETS GANG
Reagenser og klargjøring av disse
Reagensene er klar til bruk.
Holdbar til utløpsdato på fargepakke.
Analyseutstyr og klargjøring av disse
Hematek® Slide Stainer levert av Siemens
Reagens / Tilbehør:
|
LØ-nr. |
Produktnavn |
Leverandør |
|
4013593 |
Hematek Stain Pak |
Siemens |
|
4014594 |
Hematek under platen tubing |
Siemens |
|
4013569 |
Hematek Pump Tube Set |
Siemens |
|
4019067 |
Eukitt |
VWR |
|
4019075 |
Metanol |
VWR |
Ofte stilte spørsmål
- Hva er feil når det er svak/ingen farge?
Som oftest er det det luft i en eller flere slanger, slik at det ikke kommer nok farge / buffer / rinse.
Det kan også være at slange har hoppet av, hull i pumpeslange eller evt. tette slanger. - Hva er feil når en får slørete farge etter at ny
fargepakke er tatt i bruk?
Se om det er nytt lot som er tatt i bruk. Hvis det er det kan det være noe feil ved denne. Se til at det ikke har hendt noe med slanger/nåler etter at det nye reagenset er tatt i bruk. Hvis dette er i orden bør leverandør kontaktes.
NB! Ofte kan vedlikehold rette på mange problem.
Fremgangsmåte/Utførelse av analysen

1. Oppstart/Klargjøring av fargemaskin
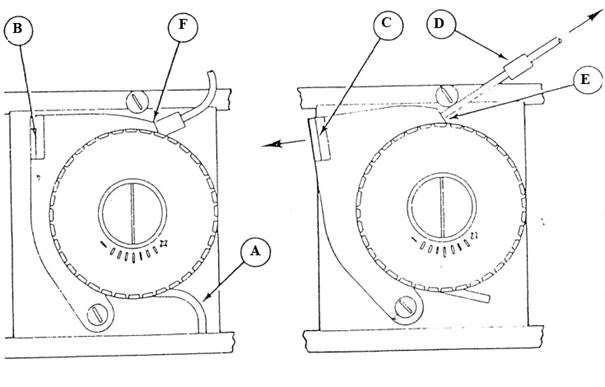
1.1. Løft operasjonshåndtaket (1) til øverste posisjon (Prime) og hold det der
1.2. Sett nål 1, som står i metanol, ned i fargeløsningen helt til høyre.
1.3. Prime til slangene er fylt med fargeløsning/buffer/rensevæske og er fri for luftbobler. Se til at det kommer jevn strøm med væske fra alle tre hullene i fargeplata (8).
1.4. Slipp operasjonshåndtaket, det vil da stille seg i midterste posisjon (On)
1.5. Tørk av fargeplata (8) og tilhørende spor med klut fuktet med metanol.
NB. Tørk fra høyre mot venstre.
1.6. Lampe for farge (Stain) lyser når det er lite fargevæske igjen (4).
2.
Farging av utstryk
Henviser til ALM-MB-Hem; Blodutstryk og Margutstryk for tillaging og
resultathåndering av blodutstryk og margutstryk.
2.1. Utstryksglass
plasseres i styreskinnene, rillene på den roterende spiralen (6). Utstryksiden
skal vende mot venstre side og den slipte kanten ut fra instrumentet.
Det er lurt å sette glassene i annenhver rille, slik at de blir ordentlig tørre
før neste utstryk faller oppå.
2.2. Glassene vil nå bli ført langs fargeplaten og kommer ferdig farget i skuff (7).
2.3. Følg med utstryksglasset til det er kommet fargeløsning under glasset.
2.4. Margutstryk farges 2 ganger.
2.5. På Levanger
legges dekkglass på ferdigfargede utstryk. Det benyttes Eukitt til montering av
dekkglass.
Namsos legger på dekkglass ved behov.
2.6. Plata vaskes med
metanol etter farging og mellom fargingene for margutstryk.
3. Daglig avslutning av fargemaskin
Utføres ved slutten av dagen
3.1. På slutten av dagen settes nålen som står i fargeløsningen (Nål 1, helt til høyre) ned i et plastrør med metanol. Deretter holdes operasjonshåndtaket (1) opp på prime helt til slangen er fri for fargeløsning, dette for å unngå krystallisering i slangen / fargeutfellinger.
3.2. Tørk av
fargeplaten (8) med klut fuktet med metanol.
NB. Tørk fra høyre mot venstre.
Tørk godt bort fargevæske som evt. ligger i spor på fargeplaten.
3.3. Sett
operasjonshåndtaket (1) ned til Unlocked.
Hvis lampen merket Stain (4) tenner når fargemaskina er på er det lite reagens og fargepakken må byttes.
4.1. Sett operasjonshåndtaket (1) helt ned til Unlocked,
4.2. Ta opp de tre nålene som sitter i den tomme fargepakken (3), og løft ut hele pakken.
4.3. Sett inn ny
fargepakke, slik at renseløsningen kommer til venstre og fargeløsningen er til
høyre.
|
Reagenslager |
|
|
Levanger |
Under vasken ved hematologi |
|
Namsos |
Hylle på reagenslageret for hematologi |
Hvis siste fargepakke tas i bruk, gis det beskjed om dette til fagbioingeniør/ spesialbioingeniør.
4.4. Sett nålene i
riktig løsning ved å punktere respektive flaske med nålen.
Ta ut nålen og drei den en kvart omdreining og sett den inn igjen i det samme
hullet. Dette for å lage større hull, for bedre ventilering.
4.5. Tøm avfallstanken (9) og vask denne.
4.6. Løft operasjonshåndtaket (1) til topp posisjon (Prime) og slipp. Operasjonshåndtaket vil plassere seg på On. Lampe for farge (Stain) (4) slukker.
4.7. Hold operasjonshåndtaket (1) opp og prime til slangene er fylt med fargevæske/buffer/rensevæske og er fri for luftbobler.
5.1. Tøm avfallskuffen (9) og skyll denne.
5.2. Tørk bort fargesøl som vises bak avfallstanken og utstrykskuffen (7).
5.3. Slå av instrumentet (på- og av-knapp er bak på instrumentet, venstre side) og løsne de to skruene på baksiden av dekslet. Løft dekselet opp og tilbake. NB! Pass på at ledningene ikke løsner.
5.4. Vask bort alt fargesøl i renner og spor på fargeplaten med metanol ved hjelp av lerretsklut og q-tips. Vask også den bakre styreskinnen (6) med en klut fuktet med metanol.
5.5. Sett på plass dekselet.
5.6. Alle de tre reagensnålene settes i plastrør med metanol
5.7. Hold operasjonshåndtaket (1) opp på prime til slangene er fylt med metanol. Nålene kan gjerne stå slik til neste dag.
Utføres ca hver 6. mnd.
Pumpeslangesettet inneholder tre slanger. Nr 1 er til fargevæska, nr 2 til bufferen og nr 3 til rensevæsken. På hver slange sitter en gummimansjett. Denne mansjetten skal sitte ved pumpearmen slik at slangen holdes på plass. Diameteren og lengden på slangen sikrer at riktig volum blir levert til utstrykene, andre slanger kan ikke benyttes.
6.1.1. Løft nålene ut av reagensflaskene.
6.1.2. Prime instrumentet til all væske er ute av slangene.
6.1.3. Slå av fargemaskina.
6.1.4. Ta slangene av nålene og av metall-niplene i veggen foran pumpene (A).
6.1.5. Fjern slangene fra pumpearmene ved å puffe venstre hjørne (B) på pumpearmen til venstre så langt det går (C). Mens pumpearmen holdes i denne posisjonen dras gummimansjetten (D) og slangen ut av pumpearmen.
6.1.6. Fest hver slange til sin respektive nål.
6.1.7. Tre de nye slangene gjennom hullene i pumpearmene (E). Skyv pumpearmen til venstre og dra slangen gjennom til gummimansjetten sitter fast ved pumpearmen (F). Slipp pumpearma. (Hvis du får problem med å tre slangene gjennom kan du slå på fargemaskina og sette den i “PRIME” i noen sekunder).
6.1.8. Fest hver slange til sin nippel (A).
6.1.9. Sett nålene tilbake i reagensflaskene.
6.1.10.Prime
pumpene til slangene er uten luft.
Utføres årlig.
Plateslangene er de slangene som bringer reagensene videre fra pumpeslangene og opp i de 3 reagensåpningene i plata.
6.2.1. Slå av fargemaskina og ta ut støpselet.
6.2.2. Løsne de 2 tommeskruene bak på frontpanelet og fjern frontpanelet.
6.2.3. Koble fra ledningene til Stain og On lampene.
6.2.4. Ta ut avfallstanken og skyll denne.
6.2.5. Koble slangen ifra metall-nippelen som befinner seg bak frontpanelet.
6.2.6. Koble fra slangen under plata ved å stikke handa gjennom avfallsåpningen.
6.2.7. Sett den nye slangen på nippelen oppe ved pumpeslangen og tre den bak frontpanelet. Er det vanskelig å tre slangen bak frontpanelet, kan de 3 skruene på frontpanelet løsnes.
6.2.8. Fest slangene under plata.
6.2.9. Sett avfallstanken på plass.
6.2.10.Skru på ledningene til Stain og On lampene.
6.2.11.Sett på frontpanelet.
6.2.12.Prime til all luft er ute av slangene.
6.2.13.Sjekk
om det er nødvendig å justere reagenspumpene.
6.3. Justering av reagenspumpene
Utføres av fag- eller
spesialbioingeniør.
Hvis reagensene flyter utover i stedet for å fylles mellom utstryksglasset og
plata, eller at fargeresultatet ikke er tilfredsstillende, trenger pumpene å
bli justert.
Små forandringer i forholdet fargeløsning/buffer vil gi enten mørkere eller lysere farging. Mengden reagens-pumpene gir i hvert enkelt steg i fargemaskina kan justeres. Tre volumkontrollhjul er tilgjengelige i luka til høyre på frontpanelet.
Reagensvolumet økes når hjulene skrus mot (+).
Mengde fargevæske og buffer reguleres slik at reagensene akkurat fyller kapillærrommet mellom utstryksglasset og plata, uten å flyte utover kantene av utstryksglasset.
Når streket på fargevæske- / buffer-kontrollhjulene står ved 0-merket er forholdet fargevæske/buffer omtrent 1:2,5.
Kontroller reagensmengdene ved å kjøre minst 5 blanke utstryksglass gjennom fargemaskina.
6.3.1. Fargevæskehjulet stilles slik at fargevæska akkurat fyller rommet mellom plata og utstryksglasset uten å flyte utover kantene på glasset.
6.3.2. Buffervolumet kontrolleres og evt. justeres når minst 2 utstryk har passert og fått passe mengde fargevæske. Når utstrykene passerer bufferområdet vil de kunne se underfylt ut pga miksefugene i plata. For stort buffervolum vil redusere denne pulseringen. Jevn væskestrøm over den andre miksefuga tyder også på for stort buffer- eller fargevæskevolum. Når utstrykene når det slette området på plata skal fargevæske-/bufferblandingen akkurat fylle området under utstrykene.
6.3.3. Utilstrekkelig skylling av utstrykene kan gi utfellinger av fargevæske. For mye rensevæske kan gi «skygge» på utstrykene. Kontrollhjulet til rensevæsken skal vanligvis være innstilt på (0).
Vurdering av resultat
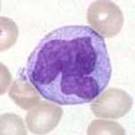
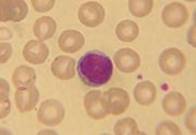
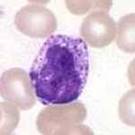
Hvite blodceller med modifisert Wright’s fargemetode:
|
Monocytt |
Lymfocytt |
Basofil |
Eosinofil |
Nøytrofil |
|
|
|
|
|
|