Omfang
Prosedyren gjelder alle ansatte som har fått opplæring i bruk av Sysmex CS-2500.
Grunnlagsinformasjon
HISTORIKK
Levanger:
2 stk. Sysmex
CS-2500 ble tatt i bruk okt-21 etter et felles
regionalt anbud.
Instrumentene betegnes som Willy (serienr. 25043) og Owe (serienr. 25044)
Namsos:
2 stk. Sysmex
CS-2500 ble tatt i bruk juni-24 (opsjon etter regionalt anbud)
Instrumentene betegnes som Instrument 1 - venstre (serienr. 26599) og Instrument
2 - høyre (serienr. 26601)
Tidligere instrument:
- STA-R Evolution: PT-INR, APTT og Fibrinogen.
- Thrombolyzer XRC: PT-INR.
- STA-Compact: APTT (APTT erstattet Cephotest fra 2/3-2011) og Fibrinogen.
- KC-4/10: PT-INR, Fibrinogen og Cephotest.
- For D-DIMER ble det brukt en Behringmetode. Skiftet metode på D-Dimer i april 2007 til Architect, senere Alinity. (Levanger: Flyttet til Sysmex CS-2500 november-23).
ANALYSEPRINSIPP OG TERMINOLOGI
Fotometrisk måling av clotdannelse.
PT-INR
Reagenset som brukes er MediRox Owrens’ PT.
Owrens metode, med følsomhet for faktorene: II, VII og X. Reagenset inneholder vevsfaktor fra kanin og bovin plasmafraksjon. Vevsfaktoren med kalsiumklorid som kofaktor aktiverer det eksterne koagulasjons-systemet.
Klottdannelsen detekteres optisk. Gjennom hele måletiden måles endring i transmisjon og reaksjonskurven monitoreres. En avvikende form på reaksjonen vil flagges.
Owrens PT-aktivitet er uttrykt i INR (Internationalt Normalisert Ratio) som er forholdet mellom prøveplasmaets og normalplasmaets koagulasjonstider, opphøyet i metodens ISI-verdi (International Sensitivity Index).
APTT
Reagenset som brukes er Dade Actin FS APTT fra Siemens Healthineers. Reagenset har høy faktorsensitivitet, er heparinsensitivt og med lav lupussensitivitet.
Analysen benytter CaCl2, samme som for PT-INR.
Ellaginsyren som aktivator induserer kontakt-aktiveringen av FXII, som videre aktiverer faktorene XI, VIII, X, V og II for å danne Trombin, ved hjelp av fosfolipider og kalsiumioner som kofaktor. Dernest omdanner trombinet fibrinogen til fibrinklott. Klottdannelsen detekteres optisk. Gjennom hele måletiden måles endring i transmisjon og reaksjonskurven monitoreres. En avvikende form på reaksjonskurven vil flagges.
Fibrinogen
Reagenset som brukes er Dade® Thrombin Reagent fra Siemens Healthineers. Clauss metode.
Måling av fibrinogen er basert på måling av koaguleringstiden for plasma fortynnet med Dade® Owren`s Veronal Buffer (OVB) etter tilsetning av Dade® Thrombin Reagent.
Trombin omdanner fibrinogen til uoppløselig fibrin. Koaguleringstiden er omvendt proporsjonal med plasmaets fibrinogen-konsentrasjonen. Klottdannelsen måles ved optisk deteksjon (transmisjon).
D-dimer
INNOVANCE® D-Dimer fra Siemens Healthineers er en partikkelforbedret, immunoturbidimetrisk metode for kvantitativ måling av krysskoblede fibrindegraderingsprodukt (D-dimer) i humant plasma.
Reagenset inneholder polystyrenpartikler som er dekt med et monoklonalt antistoff (8D3). Epitopet som binder dette antistoffet finnes flere steder i krysskoblingsregionen på D-dimer-molekylet. Dermed er det nok med ett antistoff for å utløse en aggregeringsreaksjon i en blanding av reagens og citratplasma. Dersom pasientprøven inneholder D-dimer-molekyler vil disse bindes til hverandre ved hjelp av antistoffet og danne immunkomplekser som øker prøvens turbiditet. Turbiditeten er proporsjonal med D-dimer konsentrasjonen i prøven og måles ved hjelp av foto-optisk deteksjon.
REFERANSER
Hovedreferanse:
1. Sysmex CS-2500 Norsk Brukermanual, nov-15
2. Sysmex CS-2500 Referanseveiledning 2.00, mars-16
Tilleggsreferanser:
- Produktbeskrivelser fra Siemens og MediRox
Interne valideringer:
- ALM-L-MB; Validering av Sysmex CS-2500 med analysene PT-INR, APTT og Fibrinogen (Ikke tilgjengelig)
ALM-MB-N; Verifisering av Sysmex CS-2500 med analysene PT-INR, APTT, Fibrinogen og D-Dimer (Ikke tilgjengelig)
Offisielle godkjenninger:
- Utstyr og reagens er CE merket etter IVD direktivet.
STANDARDER/KALIBRATORER
|
PT-INR |
Equalis kalibrator kit, levert av Equalis |
|
Fibrinogen |
Standard Human Plasma, levert av Siemens |
|
APTT |
Kalibrator benyttes ikke |
|
D-dimer |
INNOVANCE D-dimer Calibrator, levert av Siemens |
INTERN KVALITETSKONTROLL
|
Control Plasma N (Siemens) |
PT-INR, APTT, Fibrinogen |
|
Abnormal Multi Control OKP (MediRox) |
PT-INR, APTT, Fibrinogen |
|
INNOVANCE D-dimer Control 1 (Siemens) |
D-dimer |
|
INNOVANCE D-dimer Control 2 (Siemens) |
D-dimer |
EKSTERN KVALITETSKONTROLL
Vi deltar i Labquality Noklus-SLP 4 ganger pr år for PT-INR, APTT, Fibrinogen og D-dimer.
Resultat og vurderinger finnes i EQS.
Se prosedyre ALM-; Sammenlignende laboratorieprøvinger (SLP, ekstern kvalitetskontroll, ringtest) - håndtering og vurdering.
Arbeidsbeskrivelse
ANSVAR
Fagbioingeniør og/eller spesialbioingeniør er ansvarlig for at instrumentet til enhver tid fungerer som tiltenkt og at prosedyren er oppdatert.
Den enkelte er ansvarlig for å gjøre seg kjent med prosedyren, og utføre analysering og periodisk vedlikehold etter opplæring.
Øvrig vedlikehold utføres av faggruppe 1.
Ansvarlig fra
Medisinsk teknisk avd. er oppført i Medusa.
HMS/sikkerhetsinformasjon
Henviser til Ecoonline for reagenser.
Alle
blodprøver behandles som potensielt smittefarlig. Ved vedlikehold av instrumentet
bør en beskytte seg mot potensiell smittefare.
Se prosedyre for Usterile engangshansker. Valg og bruk av usterile hansker.
Spesielle forhold vedr. prøvetaking og forberedelse av pasient
Unngå langvarig stase, tilstreb problemfri prøvetaking. Ved bruk av butterfly bør kasteglass benyttes for å få nok blod i glasset.
Se ALM-MB-pre; Blodprøvetaking av voksne og barn.
Kapillær
prøve
Levanger:
Hvis det er vanskelig å få tatt venøs prøve, kan prøve for PT-INR tas
kapillært, anmerk da med analysekommentar at kapillær prøve er tatt.
Tas fortrinnsvis på CoaguChek - Quicks metode. Se ALM-MB-L; PT-INR på CoaguChek.
Prøvematerialet og bearbeidelse av dette
- Det
benyttes citratplasma.
Citrat-glasset fylles til strek merket på glass. Ved mindre blodmengde bør ny prøve tas. - Prøvene sentrifugeres i henhold til ALM-MB-pre; Prøvebehandling og sentrifugering.
- Plasma har ulik holdbarhet for de enkelte analysene, se metodebeskrivelsene.
Reagenser og klargjøring av disse
1. Hvor
1.1. Romtemperatur - Skuffer og skap ved instrumentene.
1.2. Kjøletemperatur - Kjøleskap(Levanger), kjølerom (Namsos).
2. Tillaging – se ALM-MB-Koag; Reagenser og kontroller til Sysmex CS-2500.
3. Annet forbruksmateriale
3.1. Rinse
Destillert vann som fylles i rengjort beholder ved
instrumentet
3.2. Antifordampingskorker og Outer ring
Finnes i to størrelser; til 5 mL- og 15 mL-flasker.
Brukes på alle reagensflaskene (unntatt CA Clean I).
Antifordampingskorkene er engangs.
Outer ring legges til vask etter bruk.
3.3.
Kyvetter
Poser á 1000 kyvetter
3.4. Trash box
Innlegg
til avfallsboksen for å unngå søl
3.5. SLD mini cups
Poser á 500 stk.
Brukes til kalibratorer og kontroller
4.
Pakningsvedlegg
Fagbioingeniør / spesialbioingeniør
har ansvar for eventuelle endringer som har betydning for analysene. Pakningsvedlegg
kontrolleres ved lotskifte (Finnes i reagenseskene eller Simens’ nettsider). Nye
utgaver arkiveres i egen perm.
Feilkilder og interferens
Se respektive metodebeskrivelser
Fremgangsmåte/Utførelse av analysen
Kort oversikt:
- Daglig oppstart
- Innsetting av reagens og kontroller
- Kontrollrutiner
- Kalibrering (ligger i bakgrunn)
- Analysering av prøver
- Vurdering av resultat
- Skrive ut resultat
- Vedlikehold
- Service / oppgradering av software
1.2.
Løs opp
Control Plasma N og OKP - daglig
D-dimer control 1 og 2 - mandag
Se ALM-MB-Koag; Reagenser og kontroller til Sysmex CS-2500.
1.3.
Bland
PT-INR-reagens som står i instrumentet.
(Husk å løse opp nytt PT-INR-reagens når nytt settes i instrumentet).
1.4. Sjekk at det er skrevet riktig holdbarhet på reagensene i instrumentet. Noen ganger «nuller» instrumentet ut holdbarheten.
1.5. Etterfyll kyvetter hvis nødvendig.
1.6. Analyser kontroller
2. Innsetting av
reagenser og kontroller
Reagens og
kontroller er ferdig barkodemerket. Unntak er OKP som benytter egenproduserte
barkoder. Reagensene settes i posisjoner som passer flaskene, evt i adapter.
C-rack (gult) benyttes til kontroller og kalibratorer.
2.1. Reagensbord
a) Marker en reagensposisjon i aktuelt rack og velg Change/Add i reagensskjermbildet.
b) Løft opp reagensseksjonslokket.
c) Sjekk at LED lyset for reagensbordet lyser grønt
d) Åpne reagensborddekselet.
e)
Plasser reagens i
racket med barkoden pekende ut.
Benytt anti-fordampningskork.
f) Sett racket i reagensbordet.
g) Lukk reagensborddekselet.
h) Senk reagensseksjonslokket.
i)
Velg OK.
2.2. Buffer/Diluent bord
a) Velg Change/Add i reagensskjermbildet.
b) Sjekk at LED lyset for buffer/diluentbordet lyser grønt
c) Åpne buffer/diluent borddekselet.
d)
Plasser
buffer/diluent i en adapter med barkoden pekende ut.
Benytt anti-fordampningskork.
e) Plasser i buffer/diluent bordet.
f) Lukk buffer/diluent borddekselet.
g) Velg OK.
2.3. Kontroller
a) Løs opp kontroller og kalibratorer som beskrevet i ALM-MB-Koag; Reagenser og kontroller til Sysmex CS-2500.
b) Pipetter hele innholdet i flasken over i en ny SLD mini cup. Unngå luftbobler.
c) Plasser SLD mini cup i den opprinnelig flasken (For OKP gjenbrukes flasken fordi vi har egne barkoder til den). Flasken med SLD mini cup settes i det gule C-racket.
d)
Settes i
reagensbordet.
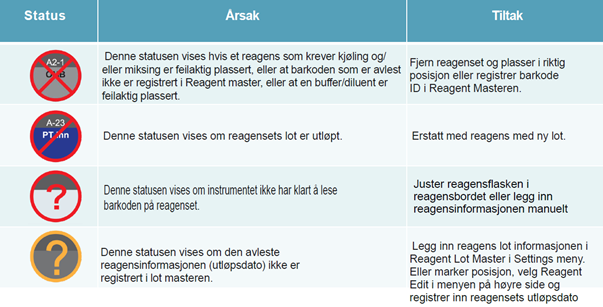
2.4. Reagensstatus
|
|
||
|
|
Denne statusen vises om holdbarheten på reagenset er utløpt |
Erstatt med nytt reagens |
3.1.
Kontroller analyseres
ifølge tabellen under.
Levanger: På helg og helligdager gjøres oppstart og morgen-kontroller av
nattevakta!
|
Analyse |
Kontroll |
Morgen |
Kveldsvakt |
Daglig, hvis det er bestilt prøve |
Når ny
flaske settes på |
|
PT-INR |
Ctrl N |
X |
X |
|
X (Owrens PT) * |
|
OKP |
X |
X |
|
X (Owrens PT) * |
|
|
APTT |
Ctrl N |
X |
|
|
(Actin FS) * |
|
OKP |
X |
|
|
(Actin FS) * |
|
|
Fibrinogen |
Ctrl N |
|
|
X |
X (Thrombin) |
|
OKP |
|
|
X |
X (Thrombin) |
|
|
D-dimer |
D-dimer Control 1 |
X |
|
|
X (Alle reagens byttes samtidig) |
|
D-dimer Control 2 |
X |
|
|
X (Alle reagens byttes samtidig) |
*For
APTT analyseres kontrollene automatisk når instrumentet starter på ny flaske
(eller tror det har ny flaske fordi vi har tatt opp flaska og satt den i igjen).
Dette gjelder også PT-INR, men reagenset skal allikevel kontrolleres når ny
flaske settes i.
3.2. Analysering av kontroller:
a) Trykk Order
b) Trykk Switch Order
c) Trykk Holder QC Order
d) Trykk Order Entry
e) Control: Velg riktig kontroll
f) Lot. No: Velg riktig lotnummer
g) Velg de ønskede analysene som det skal utføres kontroll på.
Trykk pil ned ikonet for å bestille neste kontroll.
Trykk OK når siste kontroll er bestilt.
h) Trykk Start
NB!
Kontroller til D-dimer byttes ukentlig. Oppbevares i kjøleskapet, korka
skrus på med SLD mini cup i flaska. Settes i instrumentet for analysering sammen
med de andre kontrollene og tas ut igjen så fort kontrollene er ferdig
analysert.
Dersom det står flere reagens til samme analyse på instrumentet kan det velges
hvilket reagens det skal kjøres kontroll på. Marker reagenset i
reagenskarusellen, velg Edit reagent info. Hak av QC priority før
analysering av kontroller. Merkingen forsvinner når kontrollene er ferdig
analysert.
5. Analysering av prøver
Prøvene
er barkodemerket og analysene bestilles automatisk når de leses i instrumentet.
5.1. Analysering i Auto
a) Plasser rack med barkodemerkede prøverør på innmatingsbordet.
b) Sjekk HOST tilkoblingsstatusen. HC status-ikonet må lyse grønt eller orange.
c) Trykk Start.
d)
Sjekk at
instrumentet henter de etterspurte testene på de respektive prøvene etter at barkodeavlesningen
er gjennomført. Dette gjøres i Joblist.
5.2. Analysering i manuell. Se også ALM-IKT; Nødrutiner ved datastans (Ikke tilgjengelig).
a) Plasser prøvene i et rack.
b) Trykk Order. Switch order og velg Rack order.
c) Oppgi Rack No.
d) Oppgi prøvens posisjon.
e) Trykk Order Entry.
f) Trykk Ordinary Sample.
g) Plasser pekeren på Sample No. og oppgi prøve ID. Hvis det er en barkode som scannes inn må den snus bort fra lesefeltet i racket.
h) Velg ønskede analyser som skal utføres.
i) Velg pil ned for å bestille neste prøve.
j) Trykk OK når siste bestilling er utført.
k) Sett racket i innmatingsbordet.
l) Trykk Start.
m) Sjekk prøvestatus i Joblist.
Ved
lite prøvemateriale kan prøvene bestilles i micro mode. En følger da
beskrivelsen over for manuell bestilling, men haker av i kolonnen Mc i
ordrelisten. Scann inn barkoden, men snu den bort så den ikke blir lest. Prøven
må settes på UTEN kork, og det vil ikke bli utført HIL-sjekk på disse.
5.3.
Endre til lengre
måletid / annen bølgelengde
Ved behov for å endre måletid eller bølgelengde på analysene gjøres det
automatisk for PT-INR og APTT.
Levanger: Hvis det pga interferens er behov for å endre avlesningsbølgelengde
på fibrinogen må prøven bestilles manuelt og det velges Fib 660 som
analyse.
5.4. Alle bestilte prøver (auto eller manuell) vises i Joblist, med følgende meldinger / fargekoder:

6.1. Resultatene vises i Joblist. Evt. informasjon til hver prøve vises med diverse symboler:



6.2. For å få mer informasjon om hver prøve:
a) Marker prøven i Joblist.
b) Trykk Browser.
c) Trykk Details for reaksjonskurve-informasjon.
Viser feilmeldinger
d) Trykk på reaksjonskurven for ytterligere informasjon
e) Trykk Evaluation Data for reaksjonskurveinformasjon.
f) Trykk Measurement Info.
HIL-index
vises her i tillegg til mer info
6.3. På alle prøver som er analysert i auto mode utføres HIL-sjekk. Det er lagt inn grenseverdier (HIL-index 0-5) for hva som tillates av optisk interferens før resultat må gis ut med kommentar eller avvises (Se pkt. 6.2.f)
HIL-sjekk leses av ved følgende bølgelengder:
|
|
405 nm |
575 nm |
660 nm |
|
Hemolyse |
+ |
+ |
- |
|
Icterus |
+ |
- |
- |
|
Lipemi |
+ |
+ |
+ |
Resultathåndtering:
|
Hemolyse |
|
|
|
|
Komponent |
Index |
Aksjon |
|
|
PT-INR APTT Fibrinogen D-dimer |
1-4 |
Resultat gis ut med kommentar A) (dersom ikke feilmelding på kurven) |
|
|
5 |
Resultat gis ikke ut C) |
||
|
|
|||
|
Ikterus |
|
|
|
|
Komponent |
Index |
Aksjon |
|
|
PT-INR APTT Fibrinogen D-dimer |
- Påvirker i liten grad |
Resultat gis ikke ut dersom feilmelding på kurvenD) |
|
|
|
|||
|
Lipemi |
|
|
|
|
Komponent |
Index |
Aksjon |
|
|
PT-INR APTT Fibrinogen |
Påvirker i liten grad |
Resultat gis ikke ut dersom feilmelding på kurvenE) |
|
|
D-dimer |
1-4 |
Resultat gis ut med kommentar B) Resultat gis ikke ut dersom feilmelding på kurvenE) |
|
|
5 |
Resultat gis ikke ut E) |
||
|
|
|||
|
Kommentarene finnes som Mnemonikk i resultatregistrering. |
|||
|
Kommentar |
Mnemonikk |
||
|
A) Prøven er hemolysert. Dette kan påvirke resultatet. Ny prøve anbefales. |
587 |
||
|
B) Prøven er lipemisk. Dette kan påvirke resultatet. Ny prøve anbefales. |
3507 |
||
|
C) Sterkt hemolysert prøve, analysen utføres ikke. Ny prøve bør tas. |
612 |
||
|
D) Sterkt ikterisk prøve, analysen utføres ikke. |
625 |
||
|
E) Sterkt lipemisk prøve, analysen utføres ikke. |
626 |
||
|
|
|||
|
Ved kombinasjon av lipemi og hemolyse kan det komme * på hemolysenivå. Grad av hemolyse må da vurderes visuelt. |
|||
|
|
|||
|
Spesielt for Fibrinogen: Ved kraftig hemolyse eller ikterus og feilmelding på kurven/manglende resultat analyseres Fibrinogen ved 660 nm (Levanger). Denne analysen må bestilles manuelt på instrumentet og resultat legges inn manuelt i Beaker. Ved feilmelding også ved 660 nm kan prøven analyseres med en 1/2- eller 4/1-fortynning. |
|||
|
|
|
|
|
|
In vivo hemolyse: Ved sterk mistanke om / bekreftet in vivo hemolyse kan alle resultat gis ut med kommentar* også ved hemolysegrad 5 dersom det ikke er feilmelding på kurven. |
|||
|
|
|||
|
Ved lipemi endres avlesningen automatisk til en annen bølgelengde for PT-INR og APTT (Fibrinogen – den må manuelt bestilles ved 660nm (Levanger)). |
|||
|
|
|||
6.4. Godkjenning av svar og svarrapportering
Alle unormale svar vurderes i forhold til tidligere svar, kliniske opplysninger og HIL-regler. Prøvene reanalyseres ved behov; se
ALM-MB-Koag; Sysmex CS-2500, PTINR i plasma
ALM-MB-Koag; Sysmex CS-2500, APTT i plasma
ALM-MB-Koag; Sysmex CS-2500, Fibrinogen i plasma
ALM-MB-Koag; Sysmex CS-2500, D-dimer i plasma
Svarene autoverifiseres i Beaker og går direkte i journal.
Svar som ikke går inn under autoverifiseringsreglene, verifiseres manuelt i Beaker etter vurdering av svar.
Når det er rekvirert flere analyser på samme prøve, overføres svarene til Beaker når alle analysene er ferdig. Dersom det blir en error på en av analysene (f.eks. mangler reagens) kan den ferdige analysen sendes over til Beaker ved å markere prøven i Joblist, velge Validate og så HC Output. Samme fremgangsmåte gjelder hvis prøven er merket med Review i Joblist, men svaret er ok for å gi ut.
Ved behov for å deaktivere autoverifiseringen gjøres dette i «Automatisk verifiseringsstatus» i Beaker. Velg «Paus» på det instrumentet det gjelder.
Svarrapportering er etter Avdeling for laboratoriemedisin sine rutiner, og svar utenfor ringegrenser meldes rekvirenten etter ALM-; Ringerutiner for Medisinsk biokjemi og Blodbank
Det
er felles skriver for begge instrumentene. Benytt switch-knapp for å veksle
mellom skriverne. Må lyse på den siden det instrumentet du skal skrive ut fra
er.
7.1. Skrive ut prøveresultat for en enkeltprøve
a) Trykk Joblist.
b) Velg den ønskede prøven i Joblist.
c) Trykk Print.
d) Velg Cursor Data.
e) Velg et format.
f)
Trykk Print.
7.2. Skrive ut multiple prøveresultat
a) Trykk Joblist.
b) Trykk Mark.
c) Velg de ønskede prøvene i joblist.
Current: Marker den valgte prøven
Same Date: Marker prøver med samme analysedato
All: Alle prøveresultater som vises
Release all: Fjerner merking på prøvene
d) Trykk Back.
e) Trykk Print.
f) Trykk Marked Data.
g) Velg et format.
h) Trykk Print.
i) Trykk Mark. Velg Release all for å fjerne markering. Trykk Back
8.1. Daglig vedlikehold (Levanger: På helg og helligdager utføres dette av nattevakta)
a)
·
Sett instrumentet
i shutdown (på øverste linje eller i menyen). Se til at CA Clean 1 står på
instrumentet i reagensrack.
Det kommer etter hvert valg om instrumentet skal slås helt av eller om det skal
være kjøling på reagensene. Velg å slå helt av.
· Steng IPU (kryss øverst tilhøyre)
· Slå av instrumentet (bryter på venstre side av instrumentet)
· Start opp igjen IPU ved å dobbeltklikke på ikonet.
· Slå på instrumentet når innloggingsbildet kommer opp.
·
Logg inn etter
at instrumentet er slått på. Bruker user – passord user
b)
Kast kyvetter ved
å ta ut avfallsboksen på høyre underside av instrumentet. Trykk «Yes» når du
får spørsmål om å resette telling av kyvetter.
c) Sjekk kondensfellen for væske. Denne er under luken på venstre side av instrumentet.
8.2. Ukentlig vedlikehold (mandag)
Instrumentene
brukes annenhver uke. Gjør vedlikehold på det instrumentet som skal tas i bruk.
a)
Fjern vann fra /vask
brett under instrumentet.
b)
Rengjør vanntanken
– BRUK HANSKER
Bruk springvann og litt oppvaskmiddel til å vaske innsiden av tanken og
flottørbryteren.
Skyll godt med vann, deretter destillert vann.
Skyll med sprit.
Se til at flottøren beveger seg fritt.
Tanken lufttørkes til neste uke.
Fyll ren og tørr tank med destillert vann og sett på instrumentet.
c)
På det
instrumentet som skal stå ubrukt til neste uke gjøres shutdown. Nå velges det
at det skal stå med kjøling på reagensene. (La CA Clean1 bli stående igjen i
instrumentet.)
Lukk IPU ved å krysse ut programmet.
d)
Tørk av nåla med
vann og sprit.
e) I løpet uka (eks. torsdag-fredag) startes det instrumentet som ikke brukes/står på kjøling opp en gang. Etterpå utføres shutdown, velg kjøling.
8.3. Månedlig vedlikehold (første mandag i måneden)
a)
Rengjør filter,
ett filter under instrumentet og 3 stykk bak. Bruk en støvsuger for å fjerne
støv fra filtrene.
b)
Rengjør
instrumentet med tørr eller fuktet klut.
c) Back-up
![]() Back-up av innstillingsverdier /
analyseresultater siden siste sikkerhetskopiering. Avslutt IPU (x i øvre høyre
hjørne)
Back-up av innstillingsverdier /
analyseresultater siden siste sikkerhetskopiering. Avslutt IPU (x i øvre høyre
hjørne)
På skjermen er det snarvei til Backup – trykk på den
Sett
i minnepenn
Levanger: Ligger i øverste skuff på kontoret til fagbioingeniør
Namsos: I plastboks på utprøvingslab (hylle over vekta)
Velg lagringsplass
· Removable disk (F:)
·
Lag ny mappe.
Navngis med Instrument X ååååmmdd
(eks Owe 20210826)
Option
· Sjekk at startdato for lagringen er riktig. Skal være samme dato som siste backup ble utført
· Hak av «Inkluder Log Files» og Inkluder «Operation Log Files»
Hak av «Saved date is added to the backup destination»
Ok
Velg Ok når backup er ferdig, så Cancel.
Back-up lagres på Teams av faggruppen.
Pasientsvarene er ikke lesbare før de lastes inn i instrumentet igjen.
8.4. Ved behov
Se i manual for beskrivelse av gjøremål.
a) Lampe kalibrering/ bytte lampe
b) Bytt Trash box til kyvettene
c)
Tørk kondens i
reagenskarusellen
d) Slå av og på instrumentet
· Shutdown
· Steng IPU (kryss ut øverst til høyre)
· Slå av instrumentet med bryteren
· Start IPU
· Vent til innloggingsbildet kommer opp
· Slå på instrumentet
·
Logg inn (user –
passord user)
Dersom PC’en også har vært slått av må Windows logges på.
Velg da CS Administrator
Passord
på PC Namsos: CS Admin+4230
Levanger
har ikke passord.
9. Service / oppgradering av software
Sørg for personlig kontakt med serviceperson (leverandør, med.tek…) for å få klarhet i hva servicen / oppgraderingen innebærer.
Service og oppgradering av software dokumenteres etter:
ALM-IKT; Validering og verifisering av IT-systemer