Arbeidsbeskrivelse
ANSVAR
Den som oppdager et avvik, eller får melding fra andre om et avvik eller en klage, har ansvar for at en selv eller andre utbedrer avviket og reduserer skadeomfanget så raskt som mulig, samt rapporterer avviket/klagen ved å registrere melding i EQS. Dersom avviket er spesielt alvorlig, eller dersom det haster med utførelse av omfattende tiltak, skal leder eller annet hensiktsmessig personell kontaktes.
Alle endringer som gjelder endring av metode/instrument skal meldes i EQS av aktuell fagbioingeniør. Fagbioingeniør/seksjonsleder/avdelingssjef for fagområde/seksjon/avdeling der endringen blir utført har ansvar for at nødvendige tiltak blir gjennomført i henhold til punktet Spesielt for endring.
Alle ansatte som har forslag og idéer som kan forebygge avvik, eller øke sikkerheten, kvaliteten eller effektiviteten, har ansvar for å melde dette som forbedringsforslag i EQS. Dette sørger for at forslaget får en hensiktsmessig og dokumentert behandling.
Meldingsansvarlig har ansvar for å behandle meldingene etter rutinene i denne prosedyren og HNTs overordnede prosedyrer, samt å utnytte mulighetene i EQS-avviksmodul. Meldingsansvarlig skal starte behandling av meldingen uten ugrunnet opphold.
Ved meldingsansvarliges fravær (sykdom/ferie mv.) har avdelingssjef ansvar for å flytte meldingsansvaret til annen ansatt dersom melding ikke kan avvente behandling til meldingsansvarlige er tilbake i jobb.
Validering-/verifiseringsansvarlig har ansvar for å loggføre endringer som gjelder ALMs fleksible akkrediteringsomfang, se ALM-; Fleksibel akkreditering.
ARBEIDETS GANG
Saksgang for meldinger:
o Forbedringsforslag og endringsmeldinger
o Forbedringsforslag og endringsmeldinger
o Tiltak
§ Generelt
§ Spesielt for alvorlig uønskede hendelser
Registrering av meldinger
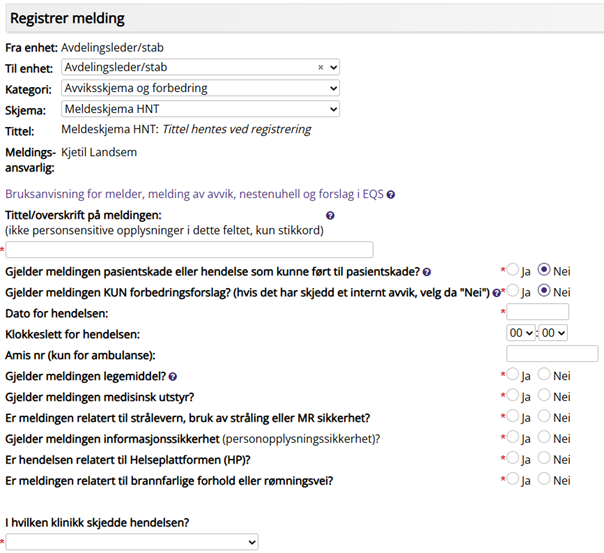
Alle meldinger registreres i EQS med funksjonen Registrer melding.
Avvik, fravik og klager
|
|
Tabell 1: Registrering av melding
|
Felt |
Forklaring |
|
Fra enhet: |
Avd for Laboratoriemedisin (ALM) er automatisk valgt
|
|
Til enhet: |
Enhet/avdeling meldingen skal sendes til.
Meldinger skal alltid meldes til egen enhet/seksjon. Meldingsansvarlig videresender til aktuell enhet. På denne måten beholder leder oversikt over avviksmeldinger skrevet av ansatte i egen enhet.
|
|
Kategori: |
Avvik og forbedringsforslag registreres på skjemaet Avviksskjema og forbedring
|
|
Skjema: |
Meldeskjema HNT (felles skjema for avvik og forbedringsmeldinger)
|
|
Meldingsansvarlig: |
Automatisk etter hvilken enhet som er valgt under Til enhet
|
|
Tittel/overskrift på meldingen: |
Kort beskrivelse av hva meldingen gjelder
|
|
Avvik i forbindelse med SLP: ALM-seksjon-SLP; Metodegruppe, SLP-nummer/ID, Navn på SLP
Eksempel: ALM-MB-L-SLP; Alinity, 2024-01, Labquality
|
|
|
Avvik eller forbedringsforslag i forbindelse med internrevisjon: IRseksjon år/revisjonsnummer, § (iht. ISO 15189:2022), Emne
Eksempel: IRBBL 2024/1 §7.2 Preanalytiske prosesser, Manglende signering |
|
|
Fravik registreres med Fravik i tittelen |
|
|
Endringsmeldinger registreres med Endringsmelding eller Endring i tittelen
|
|
|
Klager registreres med Klage i tittelen
|
|
|
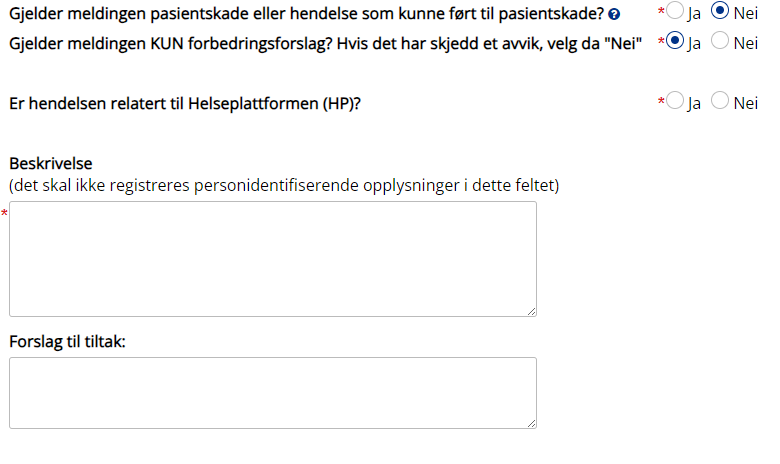
Gjelder meldingen pasientskade eller hendelse som kunne ført til pasientskade?
|
Ja: Pasientskade Nei: Avvik eller Forbedringsforslag og endringsmeldinger |
|
Gjelder meldingen KUN forbedringsforslag?
|
Ja: Forbedringsforslag og endringsmeldinger Nei: Avvik
|
|
Gjelder meldingen legemiddel?
Gjelder meldingen medisinsk utstyr?
Er meldingen relatert til strålevern, bruk av stråling eller MR sikkerhet?
Gjelder meldingen informasjonssikkerhet?
Er hendelsen relatert til Helseplattformen (HP)?
Er meldingen relatert til brannfarlige forhold eler rømningsvei?
|
Ja/Nei
Ja på ett eller flere punkt kan gi tilleggsspørsmål |
|
I hvilken klinikk skjedde hendelsen:
|
Velg riktig klinikk (ALM er underlagt Klinikk for intern service) |
|
Beskrivelse:
|
Beskriv hva som har skjedd: hva, hvem, hvor, hvordan. Ikke oppgi personidentifiserende opplysninger. Prøvenummer, rekvisisjonsnummer og/eller pasientens PID oppgis dersom det er relevant for meldingen.
Dersom det er mottatt klage noteres hvem som har levert klage og hvordan den er mottatt.
|
|
Hvilke strakstiltak er iverksatt?
|
Beskriv hva som er gjort for å begrense hendelsen og rette opp feil. |
|
Umiddelbare konsekvenser:
|
Beskriv den antatte konsekvensen for hendelsen |
|
Forslag til tiltak: |
Forslag til tiltak for å hindre at samme hendelse skjer igjen
|
|
… hvor ofte forekommer hendelser som denne i din enhet? |
Vurdering av hyppighet for lignende hendelser |
|
Vedlegg:
|
Det kan lastes opp vedlegg til meldingen. Vedleggene må ikke inneholde personidentifiserende opplysninger.
Dersom det er behov for flere vedlegg, kan disse samles i en pdf eller i en komprimert fil (bruk 7-Zip File Manager).
|
|
Registrer melding:
|
Meldingen sendes til meldingsansvarlig. Alle meldinger får en meldings-ID.
Melder kan følge behandlingsprosessen for meldingen under
|
|
Lagre utkast:
|
Lagre meldingen som utkast dersom den ikke er ferdigstilt.
|
Pasientskade
Meldinger som gjelder pasientskade
gir automatisk leserettighet til ansatte i Avdeling for kvalitet og virksomhetsstyring.
Dersom konsekvensen for pasienten er moderat eller høyere skal meldingsnummeret
legges inn i pasientjournalen, og Delskjema 4 skal tildeles
til lokalt KPU (Kvalitets- og pasientsikkerhetsutvalg). Se Bruksanvisning for melder, melding av avvik, nestenuhell og forslag i EQS.
Skjemaet for pasientskade har noen flere felt ved registrering, men fylles ellers ut på samme måte som avvik, fravik og klager.
|
|
|
|
|
|
Tabell 2: Registrering av melding - pasientskade
|
Felt |
Forklaring |
|
Pasientens PID-nr |
Unik pasientkode for EPJ i HMN. Bruk av PID gjør at man kan kommunisere om pasienter på en trygg måte. I Beaker/HP finnes HP PID i pasientens StoryBoard.
|
|
|
|
|
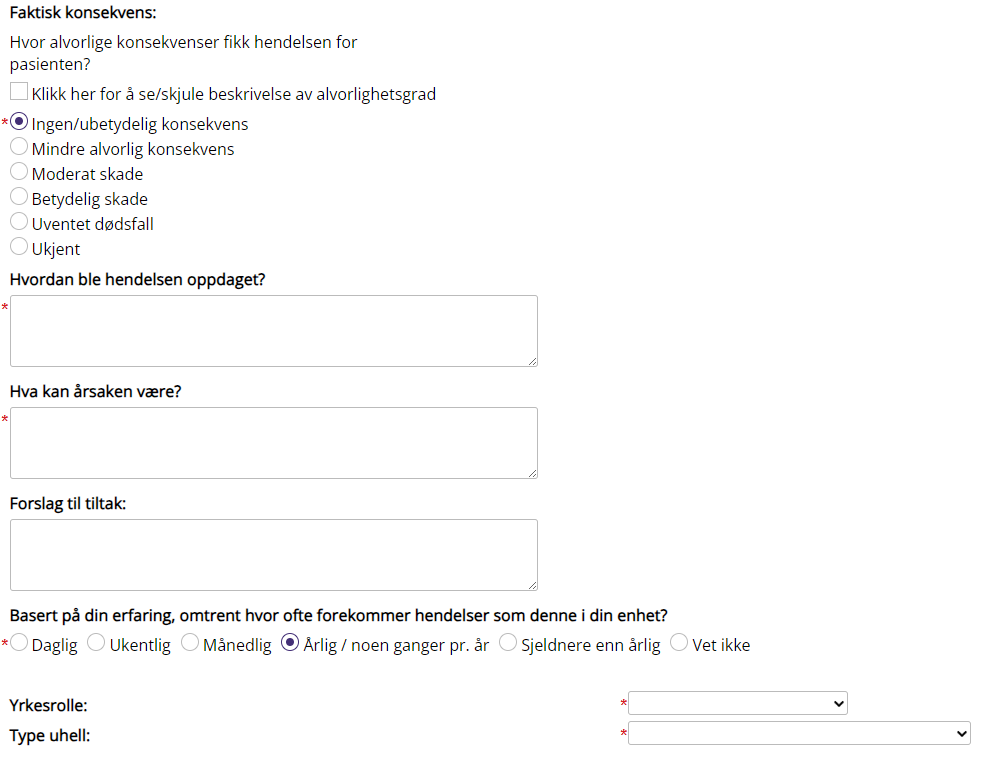
Faktisk konsekvens
|
Hvilke konsekvenser fikk hendelsen for pasienten. Forklaring til de ulike valgene står i skjemaet.
|
|
Yrkesrolle |
Melders yrkesrolle
|
|
Type uhell |
Uhell med pasientskade eller Nesten-uhell med potensiell pasientskade
|
Forbedringsforslag og endringsmeldinger
Forbedringsforslag og endringsmeldinger registreres ved å velge Ja på Gjelder meldingen KUN forbedringsforslag?
Skjemaet er forenklet. Beskrivelse og Forslag til tiltak besvares. Ellers fylles skjemaet ut på samme måte som avvik, fravik og klager.
Behandling av meldinger
Generelt
Ved registrering av melding får meldingsansvarlig varsel i EQS og på e-post. Meldingsansvarlig skal behandle meldingen etter gjeldende prosedyrer.
Se overordnet dokument Bruksanvisning for behandling av avvik i EQS, for meldingsansvarlig og Meldeportal HNT (Ikke tilgjengelig).

Tabell 3: Behandling av melding - generelt
|
Felt |
Forklaring |
|
Rediger |
Meldingsansvarlig kan korrigere meldingen ved behov, for eksempel ved
feil utfylling av feltet Gjelder meldingen KUN forbedringsforslag uten
uønsket hendelse.
|
|
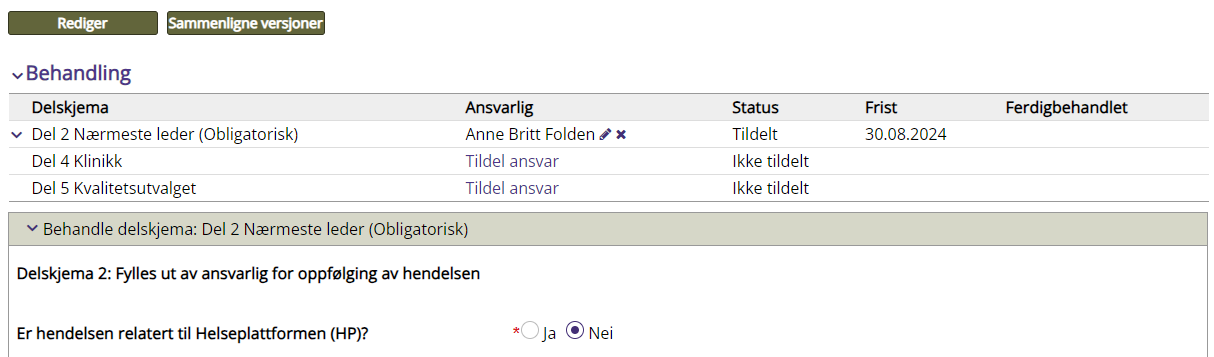
Delskjema Del 2 Nærmeste leder |
Fylles ut av meldingsansvarlig. Se Generelle frister under Bakgrunn for frist for behandling av delskjema. Se ALM-; Kvalitetsindikatorer for ALMs krav til behandlingstid for meldinger.
|
|
Delskjema Del 4 Klinikk og Del 5 Kvalitetsutvalget |
Delskjema 4 og 5 benyttes for pasientskader. Se saksgang og flytskjema: Saksgang i EQS for meldinger om pasientskader - meldingsflyt
|
|
Er hendelsen relatert til Helseplattformen (HP)? |
Ja/Nei
Ja gir flere tilleggsspørsmål |
Avvik, fravik og klager
|
|
|
|
Tabell 4: Behandling av melding – avvik, fravik og klager
|
Felt |
Forklaring |
|
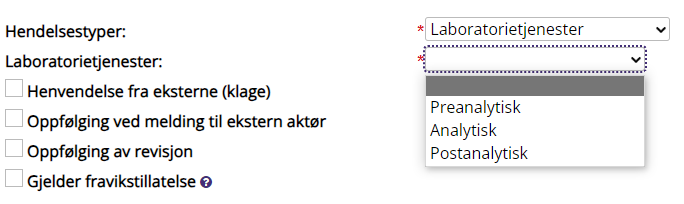
Hendelsestyper |
Hva slags hendelse er meldt. Skjemaet er dynamisk, og flere felt kan fylles ut for videre klassifisering av hendelsen. Alle avvik bør klassifiseres så nøyaktig som mulig, så det blir enklere å vurdere avviksstatistikk. Klassifisering gjøres iht. ALM-; Klassifisering av interne avvik, ikke pasientskade.
De vanligste hendelsestypene i ALM: § Laboratorietjenester: Meldingen angår flyten for pasientprøver: fra prøvetaking til endelig verifisering. Hendelsen klassifiseres videre i Preanalytisk, Analytisk eller Postanalytisk prosess § Blod og blodproduksjon: Meldingen angår prosessene i forbindelse med tapping og produksjon av blodprodukter.
Klassifisering av pasientskader gjøres iht. ALM-; Klassifisering av interne avvik, ikke pasientskade. |
|
Henvendelse fra eksterne (klage) |
Avkrysses ved klager. Aktuell klager noteres i feltet Referanse (klage)
|
|
Oppfølging ved melding til ekstern aktør (reklamasjon) |
Avkrysses ved reklamasjon til eksterne. Aktuell ekstern aktør noteres i feltet Referanse (melding til ekstern)
|
|
Oppfølging av revisjon |
Avkrysses ved interne eller eksterne revisjoner og tilsyn. Referanse til revisjon legges inn i feltet Referanse
|
|
Gjelder fravikstillatelse |
Avkrysses ved fravik fra prosedyre. Legg inn periode for fravikstillatelsen.
|
|
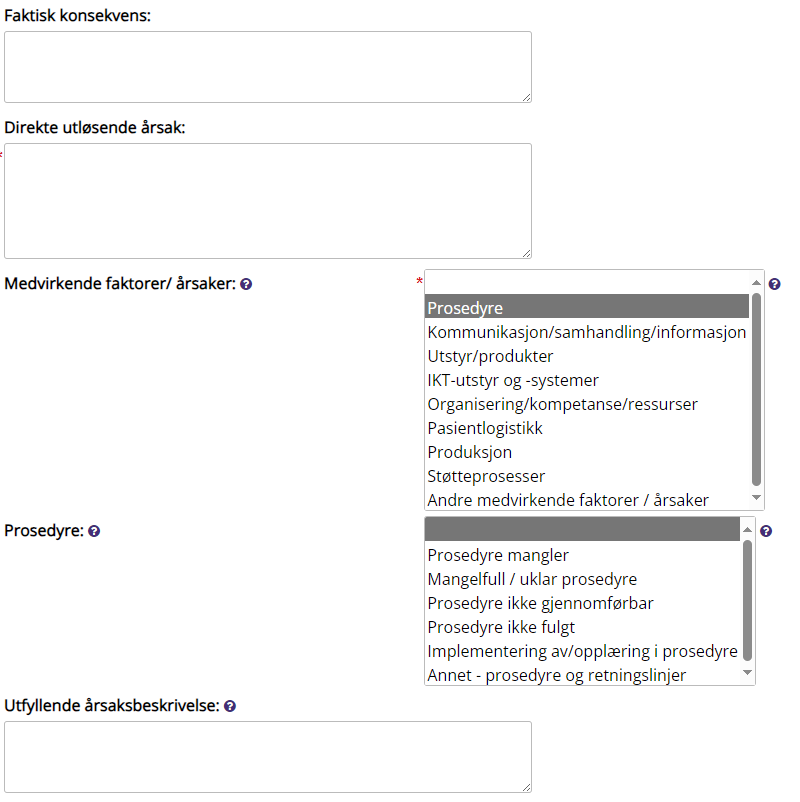
Faktisk konsekvens |
Hvilke konsekvenser har avviket fått?
|
|
Direkte utløsende årsak |
Hva er hovedårsaken til avviket?
|
|
Medvirkende faktorer/årsaker |
Medvirkende årsaker til avviket/hendelsen. Skjemaet er dynamisk, og
flere felt kan fylles ut for ytterligere klassifisering av årsak. Flere faktorer kan velges ved å holde ned ctrl.
|
|
Utfyllende årsaksbeskrivelse
|
Det skal fokuseres på system og ikke enkeltpersoner ved behandling og
oppfølging av avvik.
|
|
Oppfølging av hendelsen |
Har hendelsen skjedd tidligere?
|
|
Hvilke tiltak er planlagt for å forebygge at tilsvarende
hendelse/situasjon oppstår igjen? På hvilken måte skal tiltakene gjennomføres og til hvilken tid? |
Beskrivelse av planlagte tiltak og tidsplan for disse
|
|
Ferdigbehandlet delskjema |
Delskjema kan ferdigbehandles uten at tiltak er ferdigstilt.
Tidspunktet for ferdigbehandling registreres automatisk, og tiden brukt fra
registrering av meldingen til delskjema 2 er fullført benyttes som
kvalitetsindikator. Se ALM-; Kvalitetsindikatorer for krav til behandling av
avvik.
|
Pasientskade
Skjema for behandling av pasientskade har noen flere felt i behandlingsdelen, men fylles ellers ut på samme måte som Avvik, fravik og klager.
Alle pasientrelaterte uønskede hendelser og nesten-uhell i spesialisthelsetjenesten skal klassifiseres iht. Norsk kodeverk for uønskede hendelser.
|
|
|
|
|
|
Forbedringsforslag og endringsmelding
Skjema for behandling av forbedringsforslag og endringsmeldinger er forenklet, men fylles ellers ut på samme måte som Avvik, fravik og klager.
Endringskontroll EQS 25365: Benyttes ikke i ALM. ALM følger prosedyrene ALM-; Verifisering av produkt, metoder og utstyr og ALM-IKT; Validering og verifisering av IT-systemer og benytter ALM-; Endringskontroll, skjema (Ikke tilgjengelig).
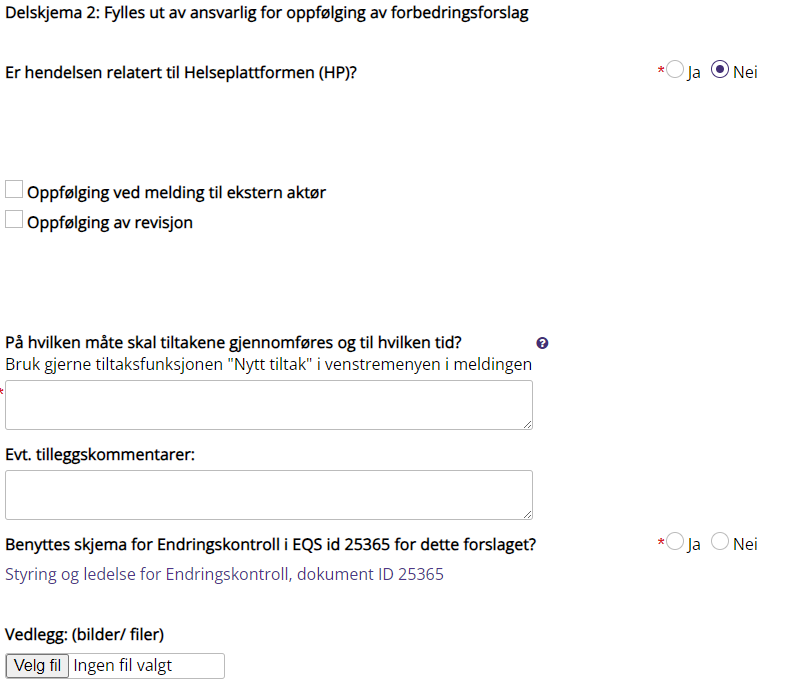
Tiltak
Tiltak brukes for å iverksette tiltak og dokumentere dette. Tiltak kan gis til alle ansatte, også utenfor egen avdeling. Ved tildeling av tiltak bør meldingsansvarlig gi tiltaksutfører leserettighet til meldingen.
Eksempler på tiltak ved avviksmeldinger/klager:
§ utføre risiko- og sårbarhetsvurdering. Se Metoder for risiko- og sårbarhetsvurderinger i HNT - ROS og ALM-; Risikoer og muligheter for forbedring
§ fremskaffe mer informasjon
§ utføre endringer i prosedyre
§ oppdatere referanser mm
§ dokumentasjon av egne tiltak
§
medisinsk faglige vurderinger
Medisinsk faglige vurderinger
gjøres i avvik/klager hvor dette er relevant, f.eks. forsinket prøvesvar, feil
prøvesvar eller manglende undersøkelse.
Vurderinger i forbindelse med forbedringsforslag/endringsmeldinger:
§ Trengs det en risiko- og sårbarhetsvurdering? (Metoder for risiko- og sårbarhetsvurderinger i HNT - ROS)
§ Hvem gjør hva når for å sette endringen i verk?
§ Hvem berøres av endringen?
§ Verifiseringsplan og –rapport
§ Er det er behov for drøftinger med andre (i eller utenfor egen avdeling)?
§ Hvordan, når og av hvem blir disse informert om denne endringen?
§ Informasjon til ansatte i ALM (beskriv måte, tid og ansvarlig) ev. andre
Når tiltakene vurderes er det viktig å tenke på læring (hindre gjentakelse) og overføringsverdi (forbedre andre områder av systemet for kvalitetsstyring, eventuelt også hos andre enheter).
Meldingsansvarlig vurderer om igangsatte tiltak skal evalueres, og setter frist og ansvarlig for dette. For klager skal tiltak evalueres etter max 180 dager.
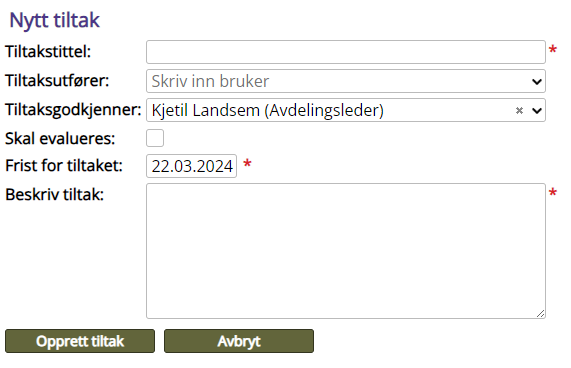
Tabell 5: Tiltak
|
Felt |
Forklaring |
|
Tiltaksgodkjenner |
Automatisk satt til meldingsansvarlig, men kan endres
|
|
Skal evalueres |
Hak av dersom effekt av tiltak skal evalueres. Tiltaksevaluerer og frist for evaluering fylles ut.
|
|
Frist for tiltaket |
Automatisk satt til 10 dager. Kan endres ved oppretting av tiltak, men kan ikke endres etterpå.
|
Lukking av melding
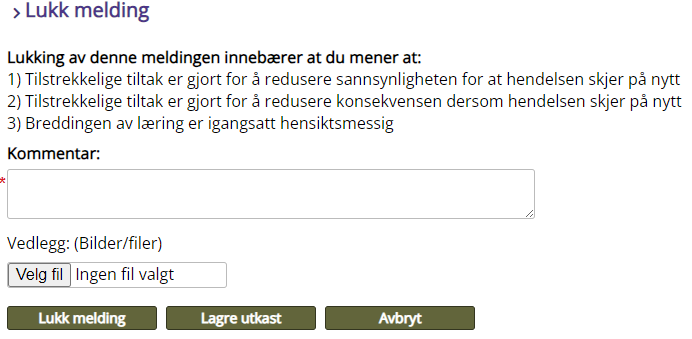
Når meldingen er ferdigbehandlet og alle tiltak er gjennomført kan meldingen lukkes. Se også Bruksanvisning for behandling av avvik i EQS, for meldingsansvarlig og Kort bruksanvisning for behandling av avvik i EQS - for meldingsansvarlig.
Kommentar: Her oppsummeres tiltak som er gjort, med vurdering og kommentar.
Generelt
Tilleggsmuligheter i EQS for meldingsansvarlig
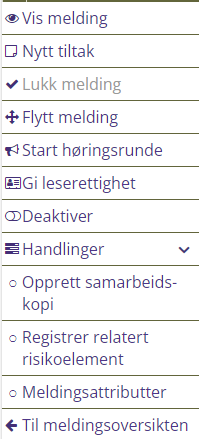
Tabell 6: Meldingsalternativer
|
Felt |
Forklaring |
|
Lukk melding |
Når meldingen er ferdigbehandlet og alle tiltak iverksatt eller gjennomført kan meldingen lukkes
|
|
Flytt melding
|
Flytt meldingen til en annen meldingsansvarlig. Kryss av for å beholde leserettighet til meldingen. |
|
Start høringsrunde |
Meldingen kan sendes på høring til aktuelle ansatte ved behov.
|
|
Gi leserettighet |
Leserettighet kan gis til enkeltpersoner eller grupper av ansatte (avdeling, seksjon og yrkesgruppe)
|
|
Deaktiver |
Meldingen kan deaktiveres ved behov. Kan ikke angres.
|
|
Opprett samarbeidskopi |
Det opprettes en identisk, men ny melding med nytt meldingsnummer. Meldingene behandles i ulike seksjoner, men meldingene blir relatert til hverandre.
|
|
Registrer relatert risikoelement |
Opprett risikovurdering direkte fra meldingen
|
|
Meldingsattributter |
Meldingens egenskaper
|
Endring av melding
Dersom det er behov for å åpne en lukket melding eller
slette et tiltak må Avdeling for kvalitet og
virksomhetsstyring kontaktes.
Spesielt for klager
Melder bør innlede emnebeskrivelsen med ordet: «Klage». Meldingsansvarlig skal krysse av for «Henvendelse fra eksterne (klage)» i behandlingsdelen slik at det kan tas ut statistikk på klager.
Klager behandles som internt avvik med to tillegg:
Alle klager/reklamasjoner oppfølges med en foreløpig tilbakemelding (gjerne
personlig eller pr telefon) til klageren uten ugrunnet opphold. Dette
dokumenteres i rapporten.
Endelig tilbakemelding til kunde bør være skriftlig hvis hensiktsmessig/relevant og da fortrinnsvis signert av avdelingssjef. Dette beskrives under korrigerende tiltak, eller henvises til brevet som vedlegg til avviket. Brev arkiveres i Elements.
Tiltak med bakgrunn i klager skal evalueres etter max 180 dager.
Behandling og lukking av klagesaker bør foretas av personer som ikke er involvert i saken som den aktuelle klagen gjelder.
Spesielt for endring
Forbedringsforslag og endringsmeldinger meldes som forbedringsmelding i EQS. Endringsmeldinger bør navngis tydelig, ved å f.eks. skrive Endring eller Endringsmelding i tittelen.
Ved endringer skal endringskontroll-skjema benyttes: ALM-; Endringskontroll, skjema (Ikke tilgjengelig). Skjemaet fylles ut av ansvarlig fagbioingeniør. Del 1 sendes til avdelingssjef og seksjonsleder som informasjon før del 2 igangsettes. Det forutsettes at leder er informert og har godkjent oppstart av endringen før endringsmelding og endringskontroll-skjema skrives. Utfylt endringskontroll-skjema legges som vedlegg til endringsmeldingen.
Hvis endringen/forslaget til endring berører metoder og instrument skal punktene i forhåndsvurderingen beskrevet i ALM-; Verifisering av produkt, metoder og utstyr være utført.
Forhåndsvurdering startes samtidig som endringsmelding registreres. Hvis endringen berører flere fagbioingeniører, samsnakkes disse og blir enig om gjennomføringen av forhåndsvurderingen. Det kan være en fordel med egne møte(r) hvor punktene i forhåndsvurderingene gjennomgås. Deltakerne i slike møter er avhengig av omfang. (Aktuelle er avdelingssjef, seksjonsleder(e), fagbioingeniør, medisinsk faglig rådgiver, verifiserings-/valideringsansvarlig, representanter fra f.eks. Medisinsk teknologisk avdeling (MTA), HEMIT, Innkjøpsavdeling m.fl.)
Spesielt for fravik
Ansvaret for fraviket og varsling av dette er fagansvarlig
eller overordnet, og dokumenteres skriftlig i meldingssystemet i EQS.
Tittel på fraviket startes med «Fravik».
Meldingsansvarlig krysser av for «Gjelder fravikstillatelse» under behandling av Delskjema 2 slik at man kan ta ut statistikk på dette.

Spesielt for blodbanken
Iht. blodforskriften § 3-5 skal blodbanker og transfusjonsenheter sørge for at alvorlige bivirkninger og alvorlige uønskede hendelser i forbindelse med tapping, testing, prosessering, oppbevaring, distribusjon og transfusjon av blod, som kan tilskrives blod eller blodkomponenters kvalitet og sikkerhet, registreres, etterforskes med tanke på å identifisere årsaker, korrigeres og meldes til hemovigilans-systemet. Dette gjelder selv om den uønskede hendelsen faktisk ikke førte til bivirkning hos mottaker eller giver av blodkomponent. Hensikten er å lære av hendelsen og redusere risikoen for nye hendelser. Dersom alvorlige uønskede hendelser kan utgjøre en fare for andre givere og/eller mottakere enn dem som er direkte berørt av hendelsen, skal blodbanken eller transfusjonsenheten straks melde hendelsen til hemovigilans-systemet. Utfyllende opplysninger om hendelsen meldes når etterforskning og korrigering er utført.
Blodforskriften oppfordrer også til å melde mindre alvorlige bivirkninger til hemovigilans-systemet.
Dersom tiltak berører prosedyrene beskrevet i ALM-BB; Oversikt over prosedyrer som skal til høring hos medisinsk faglig rådgiver SOH skal meldingen/tiltaket på høring hos medisinsk faglig rådgiver.
Blodforskriften har mange andre spesifikke krav til videre melding av ulike hendelser. Disse er beskrevet i blodforskriften og ivaretas av seksjonsleder på blodbanken.
Ved alle endringer ved blodbanken skal det vurderes om det er nødvendig med informasjon til myndigheter eller andre, herunder
· Norsk akkreditering
· Plasmapartner
· Hemovigilans
· Helsedirektoratet
· Direktorat for medisinske produkter (DMP)
Det må dokumenteres i endringsmelding at vurderingen er foretatt, og at varsling er utført.
Spesielt for alvorlig uønskede hendelser etter celleforskriftens § 53
ALM er pr 08.11.2011 godkjent etter forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (celleforskriften) for testing av donorer av celler og vev. Iht. celleforskriftens § 53 skal virksomheten registrere og straks gi melding til Direktoratet for medisinske produkter om alvorlige uønskede hendelser som skjer ved bl.a. uttak, testing, prosessering, oppbevaring og distribusjon som kan påvirke kvaliteten og sikkerheten til celler og vev. Det betyr at i tillegg til å bruke ALMs meldesystem i EQS, skal det også sendes egen melding til Direktoratet for medisinske produkter på eget meldeskjema. Skjemaet ligger som vedlegg til forskriften: Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev) - Vedlegg 1. Melding av alvorlige uønskede hendelser - Lovdata