Flytskjema
A. Analysering
B. Reagens
C. Kontroller
D. Kalibrering (Ligger i bakgrunn)
F. Service / oppgradering av software (Ligger i bakgrunn)
G. Brukermanual
A. Analysering
XN skal alltid stå på.
XN-1500 slår seg av etter shutdown og må startes etter dette.
Ved datastans følges ALM-IKT; Nødrutiner ved datastans (Ikke tilgjengelig).
PASIENTPRØVER
Henviser til ALM-MB-pre; Blodprøvetaking av voksne og barn
· Minimum 1 mL EDTA-blod (evt mindre mengde i microtainer), godt blandet.
· Etter henstand i kjøleskap må prøven romtempereres før analysering.
· Prøver bør blandes 5-20 ganger (15-20 på tilsendte prøver) før de settes i instrumentet.
Bruker fortrinnsvis EDTA-blod, uten langvarig stase. Ingen forberedelse av pasienten (Langvarig stase er definert til å vare over ett minutt). EDTA-glass med tørrstoff kan brukes selv om glasset ikke er optimalt fylt.
Alternativt prøvemateriale:
HEPARIN- og CITRAT-blod kan også
brukes. CITRAT-blod (helst SR-glass) brukes ved problemer med
trombocyttaggregering.
Husk multiplisering med fortynningsfaktor:
|
|
Faktor |
|
SR-glass |
1,25 |
|
CITRAT-glass (PT-INR) |
1,11 |
Holdbarhet av prøvemateriale; se
ALM-MB-Hem; Holdbarhet for analyser ved seksjon for hematologi
BLODBANKKONTROLLER:
Se tabell:
|
TROMBOCYTTKONSENTRAT (Levanger) Analyseres i
PLT(imp)-svaret gis ut uten
beregning. |
|
PLASMAKONTROLLER* Røde
sees som RBC-BF2. |
|
ERYTROCYTTKONSENTRAT Verdiene overføres som andre prøver til Beaker.
Pga. mangel på trombocytter vil disse bli reflex-testet med PLT-F. Dette fører til at prøven stopper i EPU med mange meldinger. |
* Ved analysering av plasmakontroller:
· Body Fluid
o Instrumentet leser strekkoden og utfører analysen
· Whole blood
o Hak vekk Read ID
o Scann strekkoden
o Hak av for PLT-F
o Hak av for Query to host
o Hak vekk Aspiration sensor
FEILKILDER OG INTERFERENS
Se metodebeskrivelse for de ulike parametere.
FREMGANGSMÅTE/UTFØRELSE AV ANALYSEN
1. Oppstart
2. Analysemodus
3. Analysetyper
a. Automatisk
b. Manuell
i. Fullblod / Low WBC
ii. Body Fluid
iii. SP-50
a. IPU
ii. Utskrift
iii. Hente frem analyserte prøver i IPU
b. EPU
i. Login
iii. 1st Level Validation
iv. Cumulated View
v. DCS Monitor
vi. Manage Orders
vii. View Locks
d. Fortynning
e. Godkjenning
g. Mangellister
· XN-1500:
· Dersom systemet er avslått
a. Slå på hovedbryter på DI (Levanger)
b. Start DI-PC inne i skapet (Levanger)
c. Trykk på hovedbryter (grønn knapp) foran på instrumentet.
d. PC som tilhører XN slås på
e. Logg på alle enheter
i.
XN:
brukernavn: alle
passord: alle
ii.
SP 50:
brukernavn: SP-50
passord: ikke noe passord, trykk OK
iii.
DI-60 (Levanger):
brukernavn: alle
passord: alle
velg HelseNordTrondelag
iv.
DC-1 (Namsos):
brukernavn: nlab
passord: nlab
velg HelseNordTrondelag
· Dersom systemet er avslått
a. Slå på tilhørende PC
b. Logg på med brukernavn og passord (alle - alle)
·
Oppstart fra
Stand by.
Instrumentet starter automatisk når det settes på et rack. Dersom instrumentet
ikke har vært brukt de siste 5 timene, trykk på startknappen (SW) på
instrumentet først.
Det er tre analysemoduser som benyttes:
· Whole Blood (WB)
· Low WBC (LW)
· Pre-Dilution – brukes ikke
· Body Fluid (BF)
·
Automatisk XN-1000 / XN-1500
Prøvene plasseres i rack á 10 prøver, barkoden
avleses og prøven vendes 10 ganger i instrumentet før den aspireres.
En sensor registrerer racket og skyver det inn i instrumentet.
Regler i Extended IPU styrer hvilke prøver som reanalyseres (kan reanalysere
automatisk bare en gang), går videre til SP-50 (blodutstryk) og evt. DI
(mikroskopering) dersom prøven er analysert på XN-1500.
·
Manuell XN-1000 / XN-1500
Prøverør blandes og
settes i enkeltvis.
Brukes som
a. Ø-hjelps-posisjon – instrumentet fortsetter der det ble avbrutt etterpå
b. Analysering av kroppsvæsker (BF)
c.
Analysering i
LW-mode
Statusindikatorlampen
må lyse grønt.
|
Trykk på modusbryteren på hovedenheten:
|
|
|
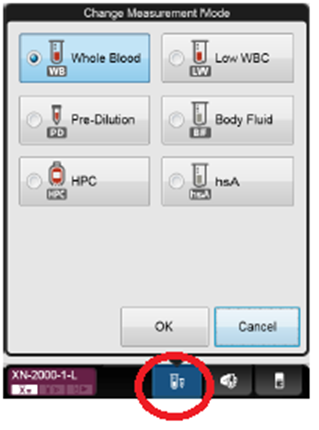
På IPU: Klikk på analysemodus-knappen og velg analysemodus
|
|
|
· Fullblod · (Fortynnet prøve – brukes ikke) · Lav WBC · Bodyfluid
|
|
|
Fullblod / Lav WBC-mode |
|
|
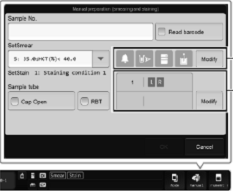
Trykk på Manuell
analyse-knapp på IPU |
|
|
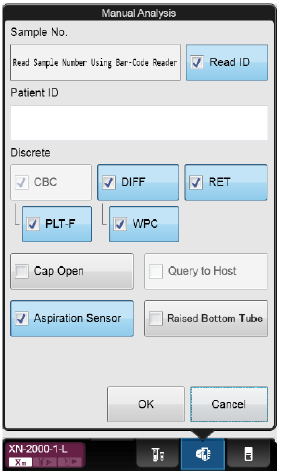
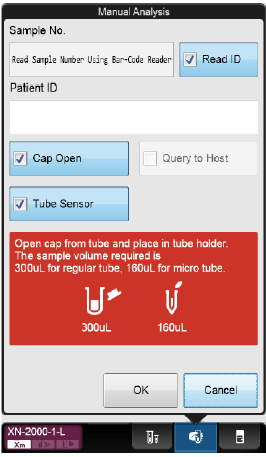
Hak av for ønsket innstilling:
· Sample No. – Prøvenummer legges inn før analysering (manuelt eller ved hjelp av håndholdt barkodeleser) · Read ID – Automatisk scanning av barkode · Discrete – Hak av de analyser som ønskes utført. (Prøvenr. må da scannes manuelt, ikke bruk Read ID) · Cap open – Analysering av prøve uten kork · Query to Host – Sender spørring til LIS · Aspiration Sensor – Ved analysering av blanke/tynne væsker som f.eks. plasmakontroller fra blodbank, evt. prøver med ekstremt lav Hb må denne være av. · Raised Bottom Tube – Ved analysering av prøve i RBT-rør (microtainer)
|
|
|
|
|
|
|
|
|
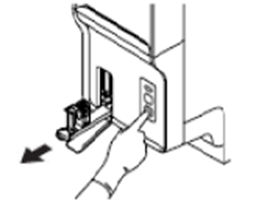
RBT-rør
plasseres i holder for normale prøverør . |
|
|
Trykk
Start (blå knapp) |
|
|
Modusknapp
(grå) endrer tilbake til automatisk modus igjen |
|
|
|
|
|
Body Fluid (BF) |
|
|
Det
utføres en automatisk bakgrunnskontroll. Etter godkjent bakgrunnskontroll
lyser indikatorlampen grønt. |
|
|
Trykk på Manuell
analyse-knapp på IPU |
|
|
Hak av for ønsket innstilling:
· Sample No. – Prøvenummer legges inn før analysering (manuelt eller ved hjelp av håndholdt barkodeleser) · Read ID – Automatisk scanning av barkode · Cap open – BF skal alltid analyseres uten kork! ·
Query to Host – Sender spørring til LIS ·
Tube sensor – Kontrollerer om et rør er plassert i
holderen. Kan fjernes om en ønsker å utføre en blank-analyse med luft.
|
|
|
Trykk
Start (blå knapp) |
|
|
Modusknapp
(grå) endrer tilbake til automatisk modus igjen |
|
|
SP-50 |
|
|
Grå magasin brukes til utstryk som ikke er mikroskopert. Blå magasin brukes til utstryk som er ferdig mikroskopert (Levanger).
|
|
|
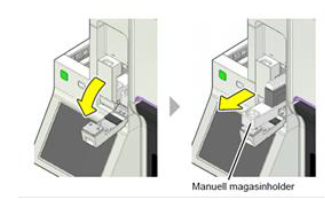
Plasser et
tomt magasin i den manuelle magasinholderen |
|
|
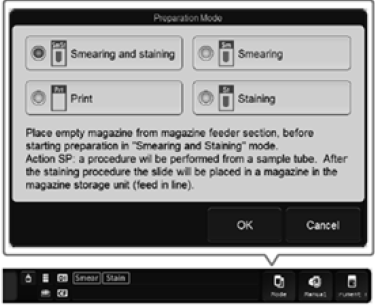
Trykk Endre
analysemodus på instrumentet |
|
|
Trykk Mode nederst på skjermen, og dette vinduet kommer opp. Velg ønsket modus og trykk OK |
|
|
|
|
|
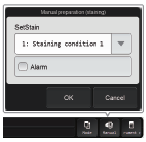
Trykk
på Manual og dette vinduet blir synlig. Dersom det skal være to utstryk kan det velges her. |
|
|
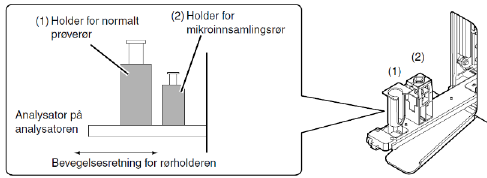
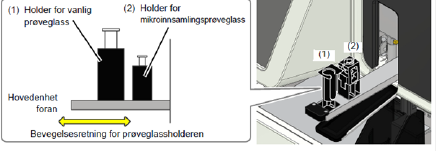
Bland prøven godt, og plasser den i prøveholderen. Det finnes to prøveholdere, en for vanlige rør og en for mikrorør |
|
|
|
|
|
|
|
|
|
|
|
Når aspirering er ferdig føres prøven ut igjen. Dersom
mode Smearing er valgt kommer utstryket ut i den manuelle magasinholderen. |
|
|
|
|
|
|
|
|
Trykk på Manual og velg protokoll |
|
|
Plasser
utstryket i magasinet og sett det i manuell magasinholderen på instrumentet. Trykk blå Start-knapp på instrumentet |
|
|
|
|
4. Analyseresultater
a. IPU
Prøveresultatene
vises på skjermen på instrumentet (IPU). Der kommer de i en liste (Explorer) og
plott og verdier kan ses i Browser.
i.
Korrigere et prøvenummer
Brukes dersom en prøve er analysert uten
prøve-ID eller ved forandring i prøve-ID.
· Velg Explorer visning
· Hvis prøven er validert fjernes V markeringen til venstre ved klikk på Validate
· Klikk Modify og velg Property
· Skriv riktig prøvenummer
·
Trykk Validate,
for å V-merke igjen. Prøven sendes automatisk til Host
ii. Utskrift av prøver
· Marker prøvene med musen. Begynn på toppen. Gå til siste og trykk Shift og klikk med musen. Prøverekkene er nå blå.
Ved markering av enkelte prøver trykkes CTRL samtidig med klikk med musen. De markerte prøvene er blå.
· Klikk på «Output» og velg Report GP evt. Report Ledger
· Du kan også skrive ut enkeltprøver i Data Browser. Husk da at de må være validert først.
·
Ved samkjøring
skrives Report For Laboratory Use Only ut.
iii. Hente frem analysert prøve i IPU
· Velg Explorer
· Klikk Find øverst på verktøylinja
· Skriv inn prøvenummer, trykk evt. PREV eller NEXT.
b. EPU
Resultatene
fra Sysmex skal vurderes i EPU (Extended IPU), som er mellomvareløsningen
mellom instrumentet og Beaker. Det er lagt inn et regelverk som styrer
reanalysering av prøver der det er behov for det, i tillegg til at det gir
informasjon om hvilke tiltak som må gjøres med prøvene. Prøvene kan «rygge» én
gang i instrumentet. Dersom det er behov for nok en reanalysering (det står
Rerun i EPU) må prøven settes på på nytt igjen. Instrumentet vet da selv hva
som skal gjøres med prøven, hvis dette gjøres innen 15 min etter den siste
analyseringen.
i.
Login
Log inn, med personlig brukernavn og passord.
ii.
View
Sample Information
Benyttes
for å søke på / se på prøveresultat.
Her kan en velge om en skal søke etter prøvenr., pasient-ID eller navn.
* etterfulgt av Enter gir deg listen over alle analyserte prøver.
Dersom det er etterrekvirering på en prøve må denne hentes her (hvis den er
ferdig validert). Trykk på «Send Validated Results», velg hvilken LIS den skal
sendes til og svarene blir overført til Beaker. Vær oppmerksom på evt. regler
som må tas hensyn til i forhold til den analysen som er bestilt.
iii.
1st
Level Sample Validation - Verifisering av prøvene
Her kommer alle prøver som ikke autovalideres på grunnlag av reglene som er
lagt inn i EPU. Lista oppdateres ved å trykke Refresh.
Det finnes to tilgjengelige lister:
«All Levanger / Namsos» viser alle prøver som er klar til verifisering.
«On Hold Levanger / Namsos» viser de prøvene som er holdt igjen, som oftest pga
at det er laget mikroskopisk kontroll. Denne lista må ryddes etter hvert, slik
at det bare ligger prøver som er lagt til mikroskopering.
|
· |
Gul
linje gir informasjon om pasienten / prøven |
|
· |
Hvit linje inneholder regeltekst som forklarer hvorfor prøven er stoppet og hva som skal gjøres og meldinger som kommer fra instrumentet |
|
· |
Utfør evt. nødvendige tiltak |
|
· |
For selv å bestille/avbestille rerun eller sette/fjerne on hold på en hel profil, høyreklikk i boksen for profilnavnet |
|
· |
For selv å bestille/avbestille rerun eller sette/fjerne on hold på hele prøven, høyreklikk på hvit linje øverst |
|
· |
For selv å bestille/avbestille rerun eller sette/fjerne on hold på enkelte parametere, høyreklikk på parameteren |
|
· |
For å holde tilbake enkelte parametere, klikk bort haken til venstre for parameteren |
|
· |
Ønsker du å se historiske data på pasienten, klikk Cumulated View eller Other Results nederst |
|
· |
Show
Multirun View viser resultat dersom prøven er analysert flere ganger. |
|
· |
View Info viser Q-flaggene som tallverdier |
|
· |
i. Result replacing comment (IKKE BRUK) ii. Result comment (kommentar til det enkelte resultat)
iii.
Validation
comment (IKKE BRUK) Høyreklikk
for å legge til kommentar på et resultat. Velg Edit comments. Fra dette
vinduet kan det velges fastkommentarer (kan også hakes av som intern
kommentar) og fritekstkommentarer. (Fritekstkommentarer går ikke over til
Beaker) Dersom
et resultat skal endres eller erstattes med Se kom skal dette gjøres i Beaker.
|
iv.
Cumulated
View
Her
kan man finne prøvehistorikk
v.
DCS
Monitor
Oversikt
over kommunikasjon mellom EPU og instrumentene. Ved kommunikasjons-trøbbel kan
man høyreklikke og velge STOP og START i LIS-kommunikasjonen. Dette i tillegg
til restart av IP-program er første tiltak ved stopp i kommunikasjonen.
vi.
Manage
Orders - View Unregistered Samples
Uregistrerte
prøver (f.eks. HbA1c, ikke-scannede prøver osv.) finnes her.
Søk etter prøver med *og Enter.
Denne lista må følges med jevnlig og ryddes daglig.
vii.
View
Locks
Prøver
kan bli låst dersom en avslutter mens man holder på med en prøve eller noen andre
står på den aktuelle prøven. Dette ses som en nøkkel ved siden av prøven i 1st
Level Validation. Disse kan låses opp i View Locks ved å dobbeltklikke på
linjen eller velge Release locks. Refresh deretter 1st Level Sample Validation
før verifiseringen kan fortsette.
c. Oppfølgende tiltak i forbindelse med
svar
Se
de ulike metodebeskrivelsene:
ALM-MB-Hem; Sysmex XN, Leukocytter (Lpk) og Differensialtelling i fullblod
ALM-MB-Hem; Sysmex XN, Erytrocytter (Epk) i fullblod
ALM-MB-Hem; Sysmex XN, HGB i fullblod
ALM-MB-Hem; Sysmex XN, Hematokritt (Evf) i fullblod
ALM-MB-Hem; Sysmex XN, MCV og MCH i fullblod
ALM-MB-Hem; Sysmex XN, Trombocytter (Tpk) i fullblod
ALM-MB; Sysmex XN Resultathåndtering i EPU
Se også:
ALM-; Ringerutiner for Medisinsk biokjemi og Blodbank
d. Fortynning av prøver
@ -
ved prøvesvaret betyr at resultatet er utenfor linearitetsområdet og må
fortynnes med CellPack.
e.
Godkjenning
og vurdering av svar/meldinger
Svarene
verifiseres i EPU. Svar som ikke omfattes av verifiseringsreglene blir
autovalidert.
Svar som ifølge verifiseringsreglene ikke blir autoverifisert vurderes nærmere
i forhold til innlagte regler og beskrivelser i de respektive
metodebeskrivelsene før de valideres i EPU.
Se ALM-MB; Tillegg til valideringsrapport Sysmex XN-1000 (Ikke tilgjengelig) og ALM-MB; Sysmex XN Resultathåndtering i EPU.
Alle svar som sendes ut av EPU vil gå direkte til Beaker. Dersom det er svar
som skal ringes vil prøven også bli stoppet for autoverifisering i Beaker.
Ved behov for å deaktivere autoverifisering må kommunikasjonen med instrumentet
avbrytes. Dette gjøres i «Automatisk verifiseringsstatus» i Beaker. Velg
Suspender på det instrumentet det gjelder.
Se
ALM-IKT; Automatisk verifisering og
ALM-; Kvalitetshåndboken til Avdeling for Laboratoriemedisin, HNT kap 5.9, Automatisk utvelgelse og rapportering av
prøveresultat.
f.
Svarrapportering
Svarene
rapporteres via laboratoriets datasystem.
Henviser til
ALM-; Ringerutiner for Medisinsk biokjemi og Blodbank
Det skal jevnlig sjekkes om det mangler svar på prøver der det forventes at det skal foreligge svar.
Dette bør gjøres ved å se på aktuelle arbeidslister, og minimum gjøres
- når mesteparten av inneliggende prøver er ferdig.
-
på slutten av dagen.
· IPU SP-50
Worklist, Browser og Status Display
· Når en trykker på Worklist- ikonet i hovedmenyen, vises en liste over alle prøver det er laget utstryk på. Ved å dobbeltklikke/trykke Browser ses detaljer på den enkelte prøve.
· Når en trykker på Status Display i hovedmenyen ses en oversikt over alle utstryk som lages/farges og man kan f.eks. søke etter prøver (Search).
B. Reagenser
Alle reagenser til Sysmex XN er klare til bruk.
Se EcoOnline for vurdering av
helse-, brann- og miljøfare.
Følgende reagenser brukes på Sysmex XN:
|
Reagens |
Brukes til |
Volum |
||
|
Cellpack DCL |
Alle kanaler
|
10 L |
||
|
Sulfolyser |
Hb
|
5 L |
||
|
Lysercell WNR |
WNR-kanal (CBC, NRBC)
|
2 x 4 L |
||
|
Fluorocell WNR |
WNR-kanal (CBC, NRBC)
|
2 x 80 mL |
||
|
Lycercell WDF |
WDF-kanal (Diff)
|
2 x 4 L |
||
|
Fluorocell WDF |
WDF-kanal (Diff)
|
2 x 40 mL |
||
|
Cellpack DFL |
RET og PLT-F
|
2 x 1,5 L |
||
|
Fluorocell RET |
RET
|
2 x 12 mL |
||
|
Fluorocell PLT |
PLT-F |
2 x 12 mL
|
||
|
Lycercell WPC
|
WPC-kanal |
2 x 1,5 L |
||
|
Fluorocell WPC
|
WPC-kanal |
2 x 12 mL
|
||
|
Cellclean |
Daglig vask
|
50 mL |
||
|
|
|||
Følgende reagenser brukes på SP-50:
|
Reagens |
Volum |
|
Cleaning Solution (Etanol)
|
2 x 5 L |
|
Buffer solution pH 6,8
|
10 L |
|
May Grünwald
|
2,5 L |
|
Giemsa
|
1 L |
|
Rinse
|
10 L |
SKIFTE AV REAGENS
XN
|
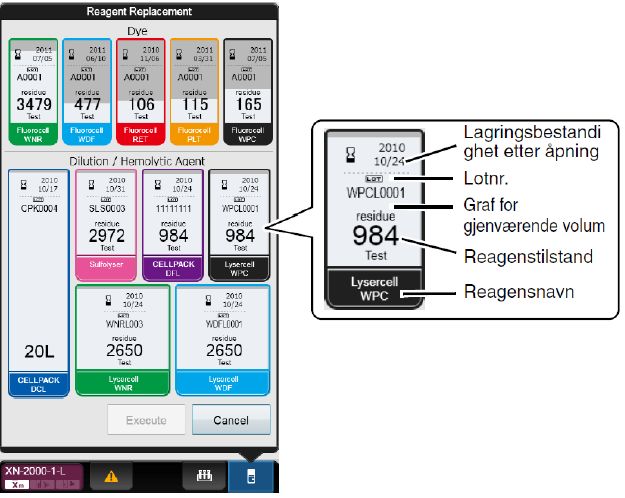
Ved hjelp av dialogboksen [Reagent Replacement] kan du kontrollere gjenværende volum og bytte reagenser. Om det går tomt for reagens under analysering, stoppes analysen midlertidig og du får opp en feilmelding i analysatorområdet på kontrollmenyen. |
|
|
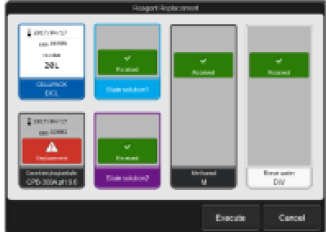
Bytte av lyse/fortynnings-reagens - Når det er tomt for et reagens åpnes Reagent Replacement automatisk. - Velg Execute. - Trykk Exchange på aktuelle reagens. - Se at Replace reagens er haket på. - Sett markøren i det blanke vinduet. - Bytt flaske, skann inn barkode, trykk OK. - Fullfør ved å trykk Execute
|
|
|
Bytte av fluorokrom-reagens - Åpne topplokket i front - Trekk opp dekselet for reagenset som skal skiftes ut. - Fjern den gamle reagenskassetten fra holderen. - Sett den nye reagenskasseten inn i holderen. Barkoden leses automatisk. - Trekk ned dekselet inntil du hører en klikkelyd.
|
|
SP-50
|
Reagens En alarm og feilmelding kommer når instrumentet er tomt for reagens. - Skift aktuelle reagens - Trykk Execute, og trykk på aktuelt reagens
Scann barkoden (gjelder ikke MayGrünwald, Giemsa og Metanol/Etanol)
|
|
|
|
|
|
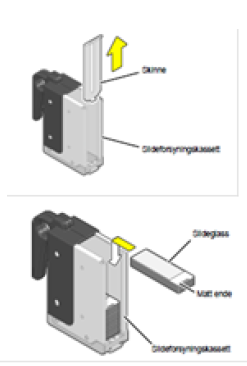
Utstryksglass - En alarm og feilmelding varsler om at det er tomt for utstryksglass
- Ta ut slideforsyningskassetten, og løft opp skinnen.
- Fyll på med nye glass (logo vender opp), fest skinnen og sett forsyningskassetten på plass.
|
|
C. Kontroller
INTERN KVALITETSKONTROLL
Det benyttes tre typer kontroller på Sysmex:
1. Interne kvalitetskontroller
2. X-bar-M
3. Samkjøring mellom instrumentene
4. Cell location på DI-60 og DC-1
1.
Interne kvalitetskontroller som benyttes leveres av
Sysmex. Det er laget av humane og animalske (hest)
blodceller og konservert i plasmalignende væske, og testet for smittsomme
sykdommer.
Kontrollene oppbevares i kjøleskap, og er holdbare
til utløpsdato, ca. to måneder fra vi mottar dem. Kontrollglassene er holdbare
i 7 dager (CBC) og 30 dager (Body Fluid) etter åpning. Fullblodskontrollene
brukes i max 7 dager (CBC – lav ktr kan måtte byttes litt oftere pga at det
blir lite prøvemateriale) og Bodyfluidkontrollene i 14 dager.
Body Fluid-kontroller analyseres i manuell uten kork.
Det er viktig at kontrollene tempereres og blandes riktig!
a. La kontrollene stå i romtemperatur ca 15 min
b. Rull kontrollene mellom hendene i 15 sek
c. Vend rørene kraftig opp og ned 20 ganger
d. Body Fluid-kontrollen blandes litt mer forsiktig
(Se Sysmex QC material preparation - YouTube)
Resultatene godkjennes og vurderes fra
uteståendelista i Beaker.
Ved ny lot kontroller legges oppgitte verdier inn. Etter noen dager
endres meanverdiene til våre innkjørte verdier dersom det er behov for
justeringer.
Se ALM-MB-Hem/Koag; Innkjøring av nye kontrollverdier i Beaker
2.
X-bar-M benyttes til å oppdage drift på instrumentet.
Verdiene finnes nederst på QC-fila og sjekkes hver morgen (ingen røde kryss i
radar-bildet).
Instrumentet varsler dessuten dersom de innlagte verdiene overskrides.
3.
Instrumentene samkjøres daglig med tre pasientprøver uten meldinger (WBC, RBC, Hb, HCT og
PLT).
Mandager utføres en utvidet samkjøring med Diff, Retic og PLT-F, i tillegg til
Hb på Hemocue.
Resultatene plottes i regneark i Teams: ALM-MB-Hem; MAL Samkjøring HEMATOLOGI
4.
Cell location
|
Cell location er et blodutstryk som brukes for å kontrollere at DI/DC (Cellavision) finner alle kjerneholdige celler i et utstryk. Kontroll på farging og mikroskop. |
|
|
Et blodutstryk med LPK i området 7-11 merkes med QC-etikett. |
|
|
|
|
|
DI-60: |
|
|
DC-1: Legges i instrumentet på samme vis som pasientprøver. |
|
|
Tørk oljen av utstryket slik at det kan brukes på nytt neste dag. |
|
|
Nytt utstryk lages ukentlig. |
|
|
Kontrollen vurderes av faggruppen. |
|
|
Instrument |
Kontroll |
Utføres Levanger og Namsos |
|
|
XN-1000 |
XN CHEK Level 1 |
Etter shutdown og på kveldsvakt |
|
|
XN CHEK Level 2 |
Etter shutdown og på kveldsvakt |
||
|
XN CHEK BF Level 1 |
Etter shutdown |
||
|
|
|
|
|
|
Instrument |
Kontroll |
Utføres Levanger |
Utføres Namsos |
|
XN-1500 |
XN CHEK Level 1 |
Etter shutdown og på kveldsvakt |
På slutten av nattevakta og på kveldsvakt |
|
XN CHEK Level 3 |
Etter shutdown og på kveldsvakt |
På slutten av nattevakta og på kveldsvakt |
|
|
XN CHEK BF Level 1 |
Etter shutdown |
På slutten av nattevakta
|
|
|
|
|
|
|
|
X-bar-M |
|
Utføres |
|
|
XN-1000 XN-1500 |
Finnes nederst i QC-bildet på IPU |
Daglig |
|
|
|
|
|
|
|
Samkjøring |
|
Utføres Levanger |
Utføres Namsos |
|
XN-1000 XN-1500 |
Tre prøver uten meldinger analyseres på begge instrumentene. |
På formiddagen |
Etter shutdown på XN-1500 |
|
|
|
|
|
|
Cell location |
Kontroll |
Utføres |
|
|
DC-1 DI-60 |
Utstryk merket med kontrolletikett settes i manuell posisjon. Vurderes av faggruppen. |
Daglig
|
|
EKSTERN KVALITETSKONTROLL
Vi benytter kontroller fra
Noklus som ekstern kontroll og følger deres program for nivå og
kontrollhyppighet.
Et eget program for RBC i plasmakontroller, levert av Equalis, følges også.
Dette administreres av Blodbanken.
Resultatene ligger i EQS.
Henviser til prosedyrene:
ALM-; Sammenlignende laboratorieprøvinger (SLP, ekstern kvalitetskontroll, ringtest) - håndtering og vurdering
E. Vedlikehold / feilsøking
|
|
|
|
|
|
|
XN-1000 / XN-1500 |
|
|
Daglig |
1. Shutdown |
|
Ukentlig |
|
|
|
|
|
Månedlig |
|
|
Kvartalsvis |
|
|
|
|
|
|
|
SP-50 |
|
|
Daglig |
8. Shutdown 1 |
|
Ukentlig |
9. Shutdown 2 |
|
|
10. Vask av fargebad |
|
|
|
|
|
|
|
Ved behov |
|
|
|
|
|
|
|
DI-60 |
|
|
Ukentlig |
17. Restart DI |
|
|
|
|
|
|
|
Ved behov |
19. Bytt olje |
DC-1 |
|
|
Ukentlig |
20. Rengjøring |
|
|
21. Restart |
|
|
|
EPU |
Medisinsk teknisk avd. er «eier» av EPU. Evt feil skal meldes MTA, de har ansvar for å melde videre til Hemit hvis feilen ligger der. |
XN-1000
/ XN-1500
1.
Shutdown – Daglig
|
· Klikk på analysatormeny-knappen |
|
|
· Velg Shutdown |
|
|
· Plasser et glass med 4 ml Cellclean (uten kork!) i prøveholderen |
|
|
· Trykk start på analyseenheten (blå knapp) · XN-1000: Etter ca 15 min kommer det en rute hvor det står «Restart». Trykk på denne og instrumentet er klart til bruk. ·
XN-1500: Instrumentet slår seg av etter vask. Shutdown utføres
samtidig som shutdown av SP. Etter ferdig vask trykkes det på den grønne
knappen på SP før PC til XN slås på. Logg på SP-50. Ikke noe passord. XN
logges på med brukernavn og passord. |
|
2.
Restart analyseinstrument – Ukentlig
XN-1500 slår seg automatisk av etter shutdown hver dag. Dette gjelder derfor
XN-1000 og DI (Levanger)
XN-1000:
|
· Trykk på Exit IPU – bekreft med Yes |
|
· Trykk på Windows Startmeny nede til venstre på skjermen |
|
· Velg Shutdown |
|
· PC og Analysator vil nå slås automatisk av |
|
· Vent 10 sekunder før PC skrus på igjen (av/på knapp på selve PCen). Analysatoren vil starte automatisk. Det vil bli utført en selvdiagnostisering i ca. 10 minutter for å påvise evt. feil i analysatoren · Se Oppstart XN-1000 · Restart samtidig Puls-PC |
|
|
3.
Lagring av pasientsvar (Lagre SMP-fil) – Ukentlig
Minnepenn til lagring av pasientsvar oppbevares på seksjonsleders kontor
(Levanger) og utprøvingslab, hylla over vekta (Namsos), som ligger i en annen
branncelle.
|
· Utføres mandag, og svar for forrige uke (mandag – søndag) skal lagres |
|
· Sett minnepenn (USB-stick) i PCen |
|
· Merk i Explorer de prøvene som skal lagres (maks 1000 prøver pr lagring) |
|
· Velg File - Backup |
|
·
Finn minnepenna (USB-sticken) under «My computer» og lag ei
mappe for aktuell uke. Velg denne slik at prøvene lagres der. |
4.
Sjekk kondensfella - Ukentlig
|
· Kondensfella finnes under samme deksel som fluororeagensene. |
|
·
Tøm den dersom det er fukt, vask den dersom det er
saltutfellinger |
|
|
5.
Backup av Sysmex – Månedlig
|
· Sysmex XN tar Back-up hver natt. Dette kan sjekkes ved å trykke på Windows-tasten på tastaturet. Velg Computer Disk D – My Backups. Da skal du se siste natts dato for backup. ·
Hver måned tar vi en manuell Back-up på ei minnepenn
(USB-stick): |
|
·
Det samme gjøres for IPU Settings. · Back-upene lagres i Teams på Faggruppe hematologi og koagulasjon (gjøres av fagbioingeniør / spesialbioingeniør). Forrige back-up slettes da fra minnepenna.
|
6.
Vask av rack og instrument – Kvartalsvis
7.
Sjekk av pakningsvedlegg og manual – Kvartalsvis
(Utføres av fagbioingeniør / spesialbioingeniør)
·
Pakningsvedleggene sjekkes kvartalsvis. Dette gjøres på
Sysmex.no. Ved evt. endringer tas utskrift som arkiveres i egen perm.
·
Gyldig versjon av manualer sjekkes også på Sysmex.no. Ved
endring, legges siste versjon i Teams.
SP-50
8. Shutdown 1 – Daglig
· Fjern evt. objektglass i den manuelle magasinholderen.
· Velg Shutdown i hovedmenyen (nederst til høyre). Den manuelle prøveluken åpnes.
· Velg Shutdown 1.
· Sett et glass med 4 mL Cellclean i prøveholderen, og trykk på blå start-knapp på instrumentet.
· Fjern det tomme glasset når prøveluken åpnes. Renseprosessen tar ca 15 min og instrumentet slås automatisk av etter vask.
· Fjern også utstryksglasset som kommer i den manuelle magasinholderen etter vasken.
·
Se pkt 1 for å slå på instrumentet igjen.
· Trykk Shutdown i hovedmenyen.
· Velg Shutdown 2.
· Plasser et rør med 4 ml Cellclean i den manuelle rørholderen.
· Trykk den blå start-knappen på instrumentet.
·
Fjern det tomme glasset når prøveluken åpnes igjen. Instrumentet
slås automatisk av etterpå.
Shutdown 2 tar 20 minutter og rengjør det hydrauliske systemet samt
fargebeholderne med etanol. Shutdown 2 avslutter med å fylle fargebeholderne
med etanol.
Instrumentet bør slås på igjen ganske raskt etter shutdown.
Fargeløsningen fylles opp når strømmen slås på igjen.
10. Vask
av fargebad – Ukentlig
Når instrumentet er avslått kan holderne i fargebadene tas ut og vaskes.
· Åpne luken øverst på venstre side av instrumentet.
· Ta ut fargebadene og legg dem i varmt vann.
· Børst av fargeutfellinger.
· Skyll med etanol (benksprit).
· Tørk av med tørkepapir og sett dem til tørk.
·
Tørk bort fargeutfellinger inne i instrumentet før det andre
settet med fargebad (vasket forrige uke) settes inn. Bruk spritservietter.
11. Tømming
av fargevæske – To ganger pr uke
·
Wastedunken i SP-50 tømmes to gang pr uke. Tømmes av portørene,
og vi får dunken tilbake når den er tom.
(Skjema som fylles ut hvis det etterspørres av
portørene: Miljødirektoratet: «Felles deklarasjon for farlig og radioaktivt avfall».
Skjemaet merkes med avfallsstoffnr 7152.)
12.
Vask av utstryksglass – Ukentlig
· Velg Spreader glass rinse i hovedmenyen (nederst til høyre). Utstryksglasset beveger seg fremover.
· Åpne lokket øverst i front av instrumentet. Ta ut objektglass-holderne før hele lokket åpnes.
· Beveg vifta fram/ned slik at spreder-glasset blir tilgjengelig uten at du trenger å ta det ut. Vask med papir fuktet med vann, og tilslutt med etanol (spritswab).
· Dytt vifta på plass, og sett tilbake objektglass-holderne.
·
Trykk ok på skjermen
14. Bytte
av utstryksglass – Ved behov
· Trykk Maintenance på menyskjermen og velg Replacement – Replace spreader glass - Ok.
· Åpne dekselet på utstryksenheten (fjern objektglassholderne).
· Legg ned viften.
· Fjern utstryksglasset fra holderen.
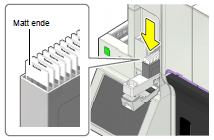
· Sett inn nytt glass slik at de små skråkantene vender forover. Sett glasset helt inn i holderen til det stopper.
·
Sett viften tilbake og lukk dekselet.
15. Bytte
av fargebånd – Ved behov
·
Se Kap 2.9 i manualen (SP-50 Feilsøking)
16.
Vask strået på Stain 1 (månedlig) Utføres av faggruppen!
Tas av og stakes opp og vaskes godt innvendig.
DI-60
(Levanger)
· Trykk File og Exit
· Ctrl-Alt-Del og velg Shutdown
·
Slå av hovedbryteren på DI
Slå på igjen:
· Slå på hovedbryteren på DI
· Slå på DI-PC i skapet
·
Logg inn (brukernavn alle, passord alle)
18.
Vask av blåe magasin – Ukentlig
·
De blåe magasinene blir tilsølt med olje. Disse leveres til vask
på vaskerommet. Rene magasin settes i instrumentet.
19.
Bytte av olje – Ved behov
·
Se Kap 10.3.1 i manualen (SP-50 Feilsøking)
DC-1
(Namsos)
20. Rengjøring
– ukentlig
· Tørk av instrumentet med en fuktet klut (vann)
· Tørk av overflødig olje på innlastningsbrettet
·
Dra ut dryppbrettet og tørk av evt dryppolje
21. Restart
DC-1 - ukentlig
Slå av:
· Slå alltid av Cellavision DM software først
· Gå til menyen Fil og velg Exit
· Velg Start og deretter Power og Shutdown
·
Lukk innmatingsluken
Slå på:
· Slå først på instrumentet og deretter Cellavicion DM software
· Sjekk at deksel og innmatingsluke er lukket
· Trykk på knappen Stand-by på instrumentet. Statuslampen lyser gult under oppstart
· Når lampen lyser grønt er det klart til bruk og innmatingsluka kan åpnes
· Dobbelklikk på ikonet Cellavicion DM Software-ikonet på skrivebordet
·
Login kommer opp – logg på og velg database
(brukernavn admin, passord admin)
Instrumentet gjør nå en selvtest før analysen kan startes
Diverse
· Vask rack, tastatur, mus og instrument ved behov. Fjern også evt. søl inne i instrumentene.
· Ved instrumentproblem / feilsøking er det viktig at det blir skrevet i Medusa!
F. Service / oppgradering av software
Sørg for personlig kontakt med serviceperson (leverandør, med.tek…) for å få klarhet i hva servicen / oppgraderingen innebærer.
Service og oppgradering av
software dokumenteres etter
ALM-; Rutiner ved instrumentsvikt, forebyggende arbeid, vedlikehold
og service av instrumenter/utstyr
ALM-IKT; Validering og verifisering av IT-systemer.
G. Brukermanual
Brukermanual finnes i IPU, både på XN og SP. Trykk Menu oppe til venstre og velg Instructions for Use.
Dette er ikke nødvendigvis gyldig versjon. Siste versjon skal ligge på Teams.